
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
分析 (1)依据热化学方程式和盖斯定律计算得到,
由盖斯定律:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534.0kJ•mol-1
③2NO2(g)N2O4(g)△H3=-52.7kJ•mol-1
②×2-①-③得到;
(2)次氯酸钠与过量的氨反应制备肼,依据反应物和生成物,结合原子守恒写出化学方程式;
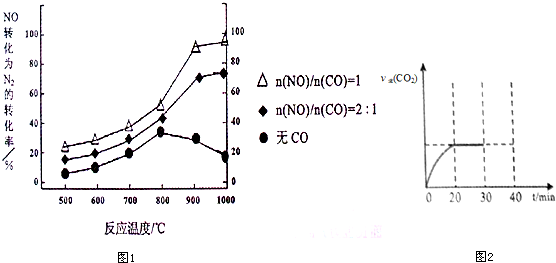
(3)①分析图表数据结合化学反应速率概念计算得到;
②反应在T2时生成物的平衡浓度减小,说明平衡逆向进行,反应是放热反应,逆向是吸热反应,依据平衡移动原理判断,T1<T2;
(4)2CO2═2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,阴极反应依据电子守恒总反应减去阳极反应得到;依据自发进行的判断依据△H-T△S<0分析判断;
(5)依据电解水的化学方程式,依据电子守恒结合电极产物分析计算;
解答 解:(1)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)═N2O4(g)△H=-52.7kJ•mol-1
依据盖斯定律②-(①+③)得到2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 083.0 kJ•mol-1;
故答案为:2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1083.0 kJ•mol-1;
(2)次氯酸钠与过量的氨反应制备肼氨气被氧化为肼,本身被还原为氯离子,结合原子守恒配平写出化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O;
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
(3)①
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
起始量(mol) 2 4 0 0
变化量(mol) 1.6 2 1.6 2.4
平衡量(mol) 0.4 2 1.6 2.4
在T1时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=$\frac{\frac{1.6mol}{2L}}{10min}$=0.08mol•L-1•min-1;
故答案:0.08 mol•L-1•min-1;
②反应在T2时生成物的平衡浓度减小,说明平衡逆向进行,反应是放热反应,逆向是吸热反应,依据平衡移动原理判断,T1<T2;
故答案为:<;
(4)2CO2═2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,阴极反应依据电子守恒总反应减去阳极反应得到:2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-);2CO═2C+O2 △H>0△S<0,△H-T△S>0,反应一定不能自发进行;
故答案为:2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-);不能,因为该反应的△S<0;
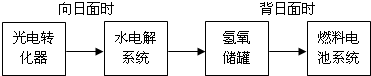
(5)氢氧储罐中共收集到33.6L气体(已折算成标准状况)物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,发生的反应为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,氢气物质的量=$\frac{2}{3}$×1.5mol=1mol,氧气物质的量为0.5mol,则该段时间内水电解系统中转移电子的物质的量为2mol;
故答案为:2;
点评 本题考查热化学方程式和盖斯定律计算应用,化学平衡的影响因素分析判断,反应速率的计算应用,原电池电极反应书写方法,电解过程中电子转移的计算应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
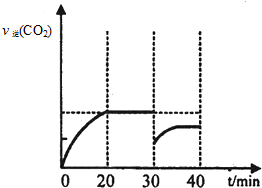
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
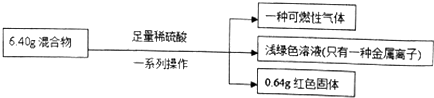
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com