
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
分析 n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则转移电子为0.1mol×(5-2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,结合选项分析.
解答 解:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则转移电子为0.1mol×(5-2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,
A.由分析可知,金属共失去电子0.3 mol,故A错误;
B.合金中,铜的质量为0.075mol×64=4.8 g,故B错误;
C.反应生成Cu(NO3)2、Fe(NO3)3和NO,以及剩余的硝酸,根据氮原子守恒可知,n(HNO3)=0.075×2+0.05×3+0.1+0.05=0.45mol,则c(HNO3)=$\frac{n}{V}$=$\frac{0.45mol}{0.1L}$=4.5mol/L,故C正确;
D.要使溶液中的金属离子完全沉淀,溶液中的溶质为NaNO3,n(NaNO3)=n(NaOH)=0.075×2+0.05×3+0.05=0.35mol,V=$\frac{n}{c}$=$\frac{0.35mol}{5mol/L}$=0.07L=70mL,故D错误.
故选C.
点评 本题主要考查混合物有关计算,涉及铁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 船舶防腐时,船体上加装的阳极锌需定期更换 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深 | |
| D. | 等体积、等浓度NaOH溶液和CH3COOH溶液混合后溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
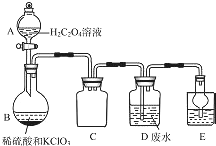 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
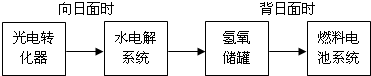
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②⑤⑥ | C. | ①④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②①④ | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
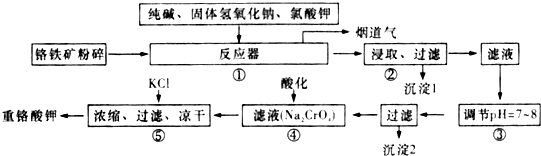
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎把浓硫酸沾在手上,立即用干布拭去,再用水冲洗 | |
| B. | 少量金属钠应保存在煤油中 | |
| C. | 氢氟酸、浓硝酸、氯水存放在带橡皮塞的棕色玻璃瓶中 | |
| D. | 漂白粉应密封保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com