
| 充电 |
| 放电 |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
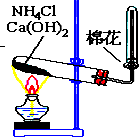 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、AlO2-、Cl-、SO42- |
| C、Cu2+、Fe3+、Br-、MnO4- |
| D、K+、Fe3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.01×1023个SO2分子的质量为32 g |
| B、CH4的摩尔质量为16 g |
| C、1 mol H2O的质量为18 g/mol |
| D、不同的气体,若体积不等,则它们所含的分子数一定不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
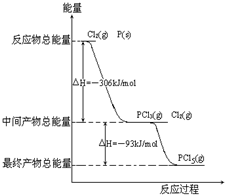
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL;21.2 g |
| B、500 mL;100.7 g |
| C、1000 mL;201.4 g |
| D、1 000 mL;212.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 验证乙醇发生消去反应生成乙烯 | 将乙醇与浓硫酸混合加热到170℃,将产生的气体通入溴水 | 酒精灯、圆底烧瓶、玻璃导管、试管 |
| B | 配制1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4?5H2O溶解在975g 水中 | 烧杯、量筒、玻璃棒 |
| C | 验证蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 验证HClO和CH3COOH的酸性强弱 | 相同条件下用pH试纸测0.1mol?L-1NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com