
【题目】在一定条件下PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
A. 1.5 mol B. 2.5 mol C. 1.0 mol D. 0.75 mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,不正确的是
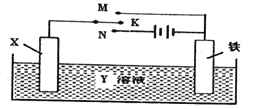
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,C的氢化物在常温下为液体,D能形成DF型离子化合物,0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,F的族序数与周期序数之差为4。请回答下列问题:
(1)写出元素符号:A________;B________; F_________。
(2)六种元素中,单质还原性最强的是______(写化学式,下同);最高价氧化物对应水化物中酸性最强的酸是__________。
(3)写出C与D形成的原子个数比为1:1的化合物的电子式:______所含化学键类型为______。
(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因:_____________。
(5)D、E元素的最高价氧化物对应的水化物发生反应的离子方程式为_________。
(6)写出用惰性电极电解饱和DF溶液的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 医用酒精的浓度通常是95%
B. 食用花生油和鸡蛋清都能发生水解反应
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两个体积可变的密闭容器中均充入1mol的A 和2 mol 的B,发生反应:A2(g)+2B2(g)![]() 2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
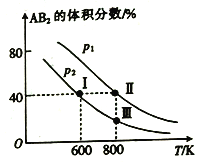
已知: ①图中I、Ⅱ、Ⅲ点均处于曲线上;②点Ⅱ时容器的体积为0.1L。下列叙述正确的是
A. 由图像可知:p1>p2 △H<0
B. 点I时A2的平衡转化率为40%
C. 点Ⅲ所对应的反应平衡常数K=0.2
D. 将点Ⅱ所对应的容器冷却到600 K,可变成点I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在溶液中因发生氧化还原反应而不能大量共存的是
A. H+、NO3ˉ、Fe2+、Na+ B. K+、Ba2+、OHˉ、SO42ˉ
C. Ag+、NO3ˉ、Clˉ、K+ D. Cu2+、NH4+、Brˉ、OHˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL 1.0mol/LNa2CO3溶液,下列操作正确的是( )
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 定容后,塞好瓶塞,反复倒转、摇匀
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应物分子的每次碰撞都能发生化学反应
B. 活化分子之间的碰撞一定是有效碰撞
C. 能够发生化学反应的碰撞是有效碰撞
D. 增大反应物浓度时,活化分子百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色
B. SiO2是酸性氧化物,能与NaOH溶液反应
C. 紫色石蕊试液滴入SO2水溶液中,先变红后褪色
D. 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com