
| 混合物 | 试剂 | 分离方法 | |
| A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
| B | 乙炔(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 苯(甲苯) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 质子数为137 | B. | 质子数为55 | ||
| C. | 电子数为82 | D. | 中子数与质子数之差为27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg (HCO3)2溶液中加入足量的Ba(OH)2:Mg2++2HCO3-+2Ba2++4OH-═Mg(OH)2↓+2BaCO3↓+2H2O | |
| B. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | K2Cr2O7溶液中加入氢氧化钠溶液,溶液颜色由橙色变成黄色,证明溶液中存在平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2混合来证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
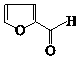 ).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(
).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(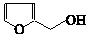 ),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.
),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.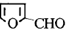 +H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$
+H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$ .
.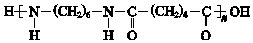
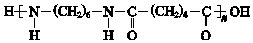 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O=2H++C1-+C1O- | |
| B. | 铝溶于过量的氨水:A1+2OH-+H2O=A1O2-+2H2↑ | |
| C. | 检验溶液中的 NH4+:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| D. | 用 H2S 处理含 Hg2+的废水:S2-+Hg2+=HgS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可生成0.4molSO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| I | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| II | 探究温度对降解速率的影响 | ① | ② | ③ | ④ |
| III | ⑤ | 298 | 10 | 6.0 | 0.30 |
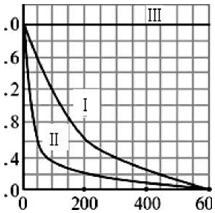
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com