
【题目】下面有关过渡元素的说法正确的是
A.新型高效催化剂多与过渡元素有关B.高效低毒农药多与过渡元素有关
C.过渡元素中只有铁、锰等少数元素存在变价D.大多数过渡元素的单质不能与酸反应
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】烟气中主要污染物SO2、NOx,为消除排放,保护环境,实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H1
NO(g)+1/2O2(g)=NO2(g) △H2
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_________。
(2) 室温下,进入反应器的NO、SO2的物质的量恒定,改 变通入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):nNO)的变化见图。说明预处理过程中NO2的物质的量变化的原因_______,在反应中SO2的物质的量几乎不发生变化的原因是_______________。

(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
①0-5min内,用SO2表示的平均反应速率v(SO2)________。
②下列说法中能判断该反应达到平衡状态的是________
a.单位时间内生成nmolSO2同时生成nmolSO3
b.SO3和O2的物质的量浓度之比1:1
C.容器内压强保持不变
d.混合气体的密度不变
e.混合气体的平均相对分子质量不变
处理方法二: 也可采用NaClO2溶液作为吸收剂对烟气进行处理。在不同温度下,NaClO2溶液脱硫(S)、脱硝(N)的反应中,SO2和NO的平衡分压Pe如图所示。

(4) 由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”、“不变”或“减小”)。
(5) 反应ClO2-+2SO32-![]() 2SO42-+Cl-的平衡常数K表达式为_______。
2SO42-+Cl-的平衡常数K表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )

A. 铜与稀盐酸B. 碳酸氢钠与氢氧化钠溶液
C. 碳酸钙与稀硫酸D. 碳酸氢铵与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,下图所示是我国化学家近年来合成的一些导电聚合物衍生物分子(Me指甲基):
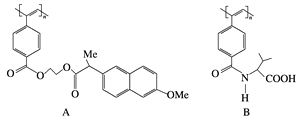
下列关于上述高分子的说法正确的是( )
①A和B的单体都是二烯烃的衍生物;
②A和B均能在一定条件下水解形成分子式相同的高分子化合物;
③B水解所得的小分子是一种α氨基酸;
④A和B各1 mol与热碱液反应,均最多消耗2 mol NaOH
A. ② B. ②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中不正确的是
A.医疗上常用体积分数为75%的酒精作消毒剂
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.氯化钠是家庭常用的防腐剂,可用来腌制食品
D.使用液化石油气不会造成厨房空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子数相同、电子总数相同的粒子,互称为等电子体。硼元素可形成三个等电子体阴离子:BO2-、BC25-和BN2n-,则BN2n-中的n值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度不变
D.向AgCl沉淀中加入NaCl固体,AgCl的沉淀溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 氢氧碱性燃料电池的负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 粗铜精炼时与电源正极相连的是纯铜,主要电极反应式:Cu-2e-=Cu2+
C. 钢铁发生电化学腐蚀的负极反应式:Fe-3e-![]() Fe3+
Fe3+
D. 钢闸门应与外接电源的负极相连,起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式___________________________________________。
(2)装置C中的试剂是______________;装置F的作用是_____________________________;
装置E中的h瓶需要冷却的理由是_____________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:______________。
②滴定前是否要滴加指示剂?_____(填“是”或“否”),请说明理由___________________。
③滴定前检验Fe3+是否被完全还原的实验操作是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com