
【题目】实验室用镁还原硝基苯制取反式偶氮苯。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
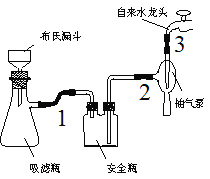
⑴在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的的原因是___________。
⑵反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤,滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要___________(填“缓慢加入”、“快速加入”)。
②烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是___________。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
③抽滤完毕,应先断开___________之间的橡皮管,以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质。
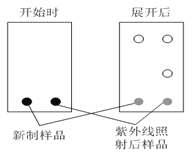
⑶薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性___________(填“强”或“弱”)。
【答案】除去镁条表面的氧化物 缓慢加入 D 抽气泵和安全瓶 趁热过滤 弱
【解析】
(1)反应加入的镁条应用砂纸打磨干净的原因是除去镁条表面的氧化物;
(2)①结晶速度越慢可得到较大颗粒的晶体,故应缓慢加入乙酸;
②将烧杯中的晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,目的是为了用减少晶体的损失.所以选择冲洗的液体应该是不会使晶体溶解损失,又不会带入杂质的.选择用滤液来物冲洗的液体是最好的,这是因为滤液是饱和溶液,冲洗时不会使晶体溶解,同时又不会带入杂质;故答案为D;
③抽滤完毕,应先断开抽气泵和安全瓶;
④重结晶过程:加热溶解→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质;
(3)极性弱的物质,在溶剂中扩散更快,根据图可知展开后顺式偶氮苯较多,扩散较慢,则反式偶氮苯比顺式偶氮苯的分子极性较弱。


科目:高中化学 来源: 题型:
【题目】汽车尾气里含有 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g) ΔH>0,已知该反应在 240℃时,平衡常数 K=64×10-4。请回答:
(1)该温度下,向 2 L 的密闭容器中充入 N2 和 O2 各 1 mol,5分钟后O2的物质的量为 0.5 mol,则 用N2表示的反应速率为________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ (填字母序号)。
A.消耗 1 mol N2 同时生成 1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将 N2、O2 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
A. 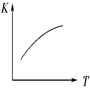 B.
B. 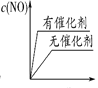 C.
C. 
(4)该温度下,某时刻测得容器内 N2 、O2、NO 的浓度分别为 2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,此时反应________ (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
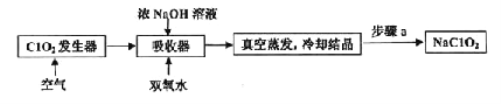
A. 通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B. 吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C. 步骤a的操作包括过滤、洗涤和干燥
D. 工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________,结构式________。
②几何构型为________。
③中心原子采取________杂化。
④PH3分子中的化学键________(填“有”或“无”)极性,其分子为________(填“极性”或”非极性”)分子。
⑤PH3与NH3的热稳定性:________更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①BaCl2②金刚石 ③KOH ④H2SO4⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,晶体以分子间作用力结合的是________。
(3)请写出③的电子式______,⑤的电子式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示,正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示反应的速率,其比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2 min内用B和C表示的平均反应速率的值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素。Z 的最高价氧化物对应的水化物为 M,室温下,0. 01 mol/L M 溶液 pH<2。下列说法中错误的是
W | X | ||
Y | Z |
A.原子半径大小:X<W<YB.Z 的单质易溶于化合物 WZ2
C.气态氢化物稳定性:W<XD.含 Y 元素的离子一定是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为主要原料,可以合成A、C、E等物质,其合成路线如图所示(部分反应条件、原料、产物已略去)。
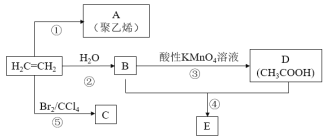
请回答下列问题:
(1)A的结构简式为______________。
(2)反应④的化学反应类型为___________________。
(3)反应⑤的化学方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com