
【题目】已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________,结构式________。
②几何构型为________。
③中心原子采取________杂化。
④PH3分子中的化学键________(填“有”或“无”)极性,其分子为________(填“极性”或”非极性”)分子。
⑤PH3与NH3的热稳定性:________更强。
【答案】![]()
![]() 三角锥形 sp3 有 极性 NH3
三角锥形 sp3 有 极性 NH3
【解析】
①NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,PH3与NH3结构相似,结构式共用电子对用短线表示;
②根据价层电子对互斥理论计算并判断;
③根据杂化轨道理论判断;
④不同非金属原子之间形成的共价键是极性键,其分子正负电荷中心不重合,结构不对称,为极性分子;
⑤非金属性越强,其简单气态氢化物越稳定。
①NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ![]() ,PH3与NH3结构相似,所以PH3的电子式为:
,PH3与NH3结构相似,所以PH3的电子式为:![]() ,用短线表示共用电子对得到结构式,所以结构式为:
,用短线表示共用电子对得到结构式,所以结构式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
②PH3分子中价层电子对数=σ键电子对数+孤电子对数=![]() ,所以磷原子采取sp3杂化,含有一对孤电子对,分子构型为三角锥形,故答案为:三角锥形;
,所以磷原子采取sp3杂化,含有一对孤电子对,分子构型为三角锥形,故答案为:三角锥形;
③PH3分子中价层电子对数=σ键电子对数+孤电子对数=![]() ,所以磷原子采取sp3杂化,故答案为:sp3;
,所以磷原子采取sp3杂化,故答案为:sp3;
④PH3分子中P-H键是不同非金属元素之间形成的极性共价键,该分子为三角锥形结构,分子结构不对称,为极性分子,故答案为:有;极性;
⑤N、P属于同一主族元素,N的非金属性强于P,非金属性越强,氢化物越稳定,PH3与NH3的热稳定性:NH3更强,故答案为:NH3。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
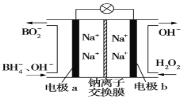
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗1molH2O2,转移的电子为1mol
D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程:
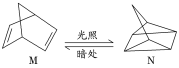
ΔH=+88.6kJ·mol-1。则M、N相比,较稳定的是_____。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为________。
(4)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。
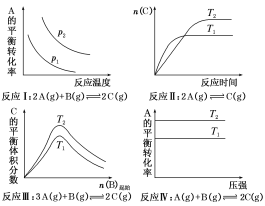
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH<0,T1<T2
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,下列说法正确的是
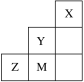
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.Z和M的最高价含氧酸中非羟基氧原子数分别为2和3
D.Z元素基态原子的轨道表示式为:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
)是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
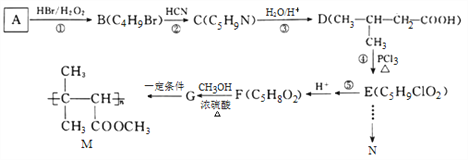
已知:I. ![]()
II. ![]()
请回答下列问题:
(1)A分子中共面的原子数最多为________个,-CN的电子式为_______________。
(2)②的反应类型为________________, E分子中所含官能团的名称为____________,G的结构简式为_____________________。
(3)写出反应⑤的化学方程式__________________________________________,写出M在酸性条件下水解的化学方程式_________________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有______种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:____________________。
(5)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)_____________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)  2H2O+2Cl2
2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4
B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2
D.O2>KMnO4>MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组设计了相关实验来探究元素周期律。该组同学为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
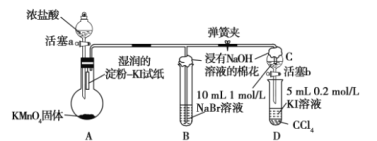
实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a;
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后![]() 层溶液变为紫红色。
层溶液变为紫红色。
请回答下列有关问题。
(1)B中溶液由黄色变为棕红色时发生反应的离子方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是______。
(3)B和C仪器口放置浸有![]() 溶液的棉花的作用是______。
溶液的棉花的作用是______。
(4)由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐______(填“减弱”或“增强”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com