
����Ŀ��ʵ������NaClO3��Na2SO3��ȡClO2���壬����ClO2��ǿ�����������������H2O2��Ӧ�Ƶ�Ư��NaClO2��װ����ͼ1��ʾ���� 
��֪����ͼ2������I��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO33H2O������38��ʱ����������NaClO2������30% H2O2����40��ʱ����ȫ�ֽ⣻������60��ʱNaClO2�ֽ��NaClO3��NaCl��
��1��ͼ1װ��A�����ķ�Ӧ�У���ԭ���� ��
��2��ͼ1װ��B�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ �� ��ʵ����ͼ1װ��B������¶ȿ��Ʋ�����40�棬�ڲ��ı�NaOH��ҺŨ�Ⱥ�����������£��ɲ�ȡ�Ĵ�ʩ���� ��
��3���벹���ͼ1װ��B��Ӧ�����Һ�л��NaClO2����IJ������裮 ����55�� ʱ�����ᾧ���������������õ���Ʒ��
��4��ͼ1װ��C�������� ��
��5��֤��ʵ���ͼ1װ��B���û����Һ�е�NaClO2���������Ե�ʵ�鷽���� �� ���ɹ�ѡ�õ��Լ���ϡH2SO4��FeCl2��Һ��KSCN��Һ��
���𰸡�
��1��Na2SO3
��2��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2�������μ����ᡢH2O2��װ��B����ˮԡ��
��3�����ȣ�������38�棩���ˣ���38��60����ˮϴ�ӣ�����60�����
��4����ֹD�е���Һ������Bƿ����ȫƿ����
��5�������Һ������40����60��֮���ȥH2O2 �� ��ȴ���ټ���FeCl2��Һ�뼸��KSCN��Һ����Һ��Ѫ��ɫ��֤��NaClO2����������
����������1��Aװ�õķ�ӦΪ2NaClO3+Na2SO3+H2SO4=2ClO2��+2Na2SO4+H2O��Na2SO3����Ԫ�ػ��ϼ����ߣ�������������ԭ�������Դ��ǣ�Na2SO3����2����Bװ��ΪClO2��ǿ�����������������H2O2��Ӧ�Ƶ�Ư��NaClO2 �� ��ѧ����ʽΪ��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2��
���Դ��ǣ�2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2����ʵ����ͼ1װ��B������¶ȿ��Ʋ�����40�棬�ڲ��ı�NaOH��ҺŨ�Ⱥ�����������£��ɲ�ȡ�Ĵ�ʩ�л����μ����ᡢH2O2��װ��B����ˮԡ�ȣ�
���Դ��ǣ������μ����ᡢH2O2��װ��B����ˮԡ�ȣ���3����֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO33H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl����ͼ1װ��B��Ӧ�����Һ�л��NaClO2����IJ�������Ϊ����55��ʱ�����ᾧ�����ȣ�������38�棩���ˣ���38��60����ˮϴ�ӣ�����60�����õ���Ʒ��
���Դ��ǣ����ȣ�������38�棩���ˣ���38��60����ˮϴ�ӣ�����60������4��Cװ��Ϊ��ȫƿ����ֹD�е���Һ������Bƿ�У�
���Դ��ǣ���ֹD�е���Һ������Bƿ����ȫƿ���У���5��װ��B���û����Һ�е�NaClO2����H2O2 �� ��֤NaClO2���������ԣ����Ƚ�H2O2��ȥ�������������Ӽ��飬ʵ�鷽���ǣ�װ��B���û����Һ������40����60��֮���ȥH2O2 �� ��ȴ���ټ���FeCl2��Һ�뼸��KSCN��Һ����Һ��Ѫ��ɫ��֤��NaClO2���������ԣ�
���Դ��ǣ������Һ������40����60��֮���ȥH2O2 �� ��ȴ���ټ���FeCl2��Һ�뼸��KSCN��Һ����Һ��Ѫ��ɫ��֤��NaClO2���������ԣ�


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⱥ��NaCl��Һ�ǻ�ѧ��ҵ����Ҫ��Ӧ֮һ��20��ʱ������NaCl��Һ���ܶ�Ϊ��g��cm-3�����ʵ���Ũ��Ϊcmol��L-1��������˵���в���ȷ���ǣ� ��
A. �¶ȸ���20��ʱ������NaCl��Һ���ܶȴ�����g��cm-3
B. ����Һ��NaCl����������Ϊ58.5c/(1000��)%
C. 20��ʱ��Ũ��С��c mol��L-1��NaCl��Һ�Dz�������Һ
D. 20��ʱ������NaCl��Һ���ܽ��S=5850c/(1000��-58.5c)g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ij������ɫ��Ӧ�ʻ�ɫ���������п϶�������K+
B. ���˲���ʱ��Ϊ�˼ӿ���˿����ò���������©����Һ��
C. ����װ���У��¶ȼ�ˮ�����λ��Ӧ����������ƿ��֧�ܿڸ���
D. ���ε��ᴿʵ���У���Һ�������м��������ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
2H2��g��+O2��g���T2H2O��l����H=��571.6kJmol��1��
CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890kJmol��1 ��
����H2��CH4�Ļ������112L����״������ʹ����ȫȼ������CO2��H2O��l������ʵ���÷�Ӧ����3695kJ����ԭ���������H2��CH4�����ʵ���֮���ǣ� ��
A.1��1
B.1��3
C.1��4
D.2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����1mol H2��1mol Cl2��Ӧ����2mol HClʱ���ų�184.6kJ�������������۷���������ʵ���������в��죬��ͼ��ʾ������Ӧ�����仯�����۷���ʾ��ͼ��
��1����ѧ��������Ҫ����ͷš������ա���������
��2��ͼ�б�ʾ�����պ��ͷŵ������������ͷŵ�������kJ��
��3���÷�Ӧ�ķ�Ӧ���������������ڡ��������ڡ���С�ڡ�����Ӧ��������������Ը÷�Ӧ��������ȡ������ȡ�����Ӧ��
��4����ͼʾ���ݼ����䷴Ӧ�ȣ�д���÷�Ӧ���Ȼ�ѧ����ʽ 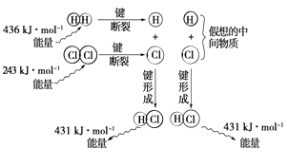
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȷ���ʽ��д��ȷ���ǣ� ��
A.2SO2+O2=2SO3��H=��196.6 kJ/mol
B.2H2��g��+O2��g��=2H2O��l����H=��517.6 kJ/mol
C.H2��g��+ ![]() O2��g��=H2O��l����H=��285.8 kJ
O2��g��=H2O��l����H=��285.8 kJ
D.C��s��+O2��g��=CO2��g����H=+393.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.�����£��� ![]() =1012����Һ�У�Fe2+��I����NO3����Cl��һ�����ܴ�������
=1012����Һ�У�Fe2+��I����NO3����Cl��һ�����ܴ�������
B.H2A�Ƕ�Ԫ���ᣬ�����£�0.1mol/LNaHA��Һ��pHԼΪ5��˵��HA������̶ȴ���ˮ��̶�
C.ʹ�ô���һ���ܹ����ͻ�ѧ��Ӧ�ķ�Ӧ�ȣ���H��
D.NAΪ�����ӵ�������ֵ�����³�ѹ�£�28gC2H4��C3H6������庬�е�ԭ����Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25���101kPaʱ
��CO��g��+ ![]() O2��g���TCO2��g����H1=��a kJ/mol
O2��g���TCO2��g����H1=��a kJ/mol
��H2��g��+ ![]() O2��g���TH2O��l����H2=��b kJ/mol
O2��g���TH2O��l����H2=��b kJ/mol
��C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��l����H3=��c kJ/mol
��1���Լ���2CO��g��+4H2��g���TH2O��l��+C2H5OH��l���ġ�H= ��
��2���Է�ӦN2O4��g��2NO2��g����H��0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵�� ����ȷ����________
A.A��C����ķ�Ӧ���ʣ�A��C
B.B��C����������ƽ����Է���������B��C
C.A��C�����������ɫ��A�Cdz
D.��״̬A��״̬B�������ý��µķ���
��3����100��ʱ����0.50mol��NO2�������2L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ�������ݣ�
ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
n��NO2��/mol | 0.50 | n1 | 0.34 | n3 | n4 |
n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
�����������£�ǰ20�����������ƽ����Ӧ����Ϊ ��ƽ��ʱ����������ת����Ϊ ��
�ڸ��¶��£���Ӧ��ƽ�ⳣ��KֵΪ ��������һλС����
��4���״���������ȼ�ϵ�أ������ΪKOH��Һ���õ��㷺Ӧ�ã���д����ȼ�ϵ�ظ����ĵ缫��Ӧʽ ����ͨ�����֮ǰ�����KOH��Һ��Ũ��Ϊ0.6mol/L�����Ϊ100mL��������ת��0.15mol��������Һ��pHΪ ����������ֲ��䣬����������
��5�������ָ�����������Һ������ƽ��ʱ���ѵ���ĵ���ʷ�����ռԭ���ܷ������İٷ������������£�c mol/L��ˮ�ĵ���ƽ�ⳣ��ΪKb �� ��ð�ˮ�ĵ���� ��= ��������c��Kb��ʾ���ɽ��н��Ƽ��㣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ������������ԭ��Ӧ�����ܴ����������
A. K+��Fe2����MnO4����H+B. Fe3����SCN-��Cl����K+
C. Ba2����Na����SO32����OH��D. NH4+��SO42-��OH����Mg2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com