ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ����ʵ����⣮
��֪��CO��g��+H
2O��g��?H
2��g��+CO
2��g����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� |
400 |
500 |
830 |
1000 |
| ƽ�ⳣ��K |
10 |
9 |
1 |
0.6 |
�Իش���������
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=
��
��2����������Ӧ�ǣ�
����
����
��Ӧ��ѡ����ȡ����ȣ���
��3��ij�¶���������Ӧƽ��ʱ�����ݡ������¶ȣ�ԭ��ѧƽ����
��
��
��Ӧ�����ƶ�����������桱��������Ӧ����
����
����
�����������С�����䡱���������ڻ�������ѹǿ
����
����
�����������С�����䡱����
��4�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������
bc
bc
����ѡ�۷֣���
a��������ѹǿ���� b����������� c��CO������
c��v
����H
2��=v
����H
2O�� d��c��CO
2��=c��CO��
��5��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO
2��?c��H
2��=c��CO��?c��H
2O�������жϴ�ʱ���¶�Ϊ
830
830
�森
��6����830�淢��������Ӧ�����±��е����ʵ���Ͷ����ݷ�Ӧ��������������Ӧ�����ƶ�����
BC
BC
��ѡ��A��B��C��D����
|
A |
B |
C |
D |
| n��CO2�� |
3 |
1 |
0 |
1 |
| n��H2�� |
2 |
1 |
0 |
1 |
| n��CO�� |
1 |
2 |
3 |
0.5 |
| n��H2O�� |
5 |
2 |
3 |
2 |



 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
 H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����
H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯����� 2CO��g��ƽ�ⳣ��K��
2CO��g��ƽ�ⳣ��K�� CO��g��+H2��g�� ƽ�ⳣ��K1��
CO��g��+H2��g�� ƽ�ⳣ��K1�� H2��g��+CO2��g�� ƽ�ⳣ��K2��
H2��g��+CO2��g�� ƽ�ⳣ��K2��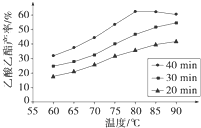 ��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������CH3COOH��l��+C2H5OH��l��
��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������CH3COOH��l��+C2H5OH��l��