
【题目】某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中-lgc(M)(M为Cl-或CrO42-)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确的是( )
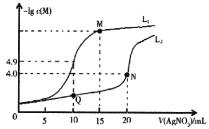
A.曲线L1表示-lgc(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应是重要的化工反应,请回答下列问题:
(1)①NH3(g)+![]() O2(g)
O2(g)![]() NO2(g)+
NO2(g)+![]() H2O(g) △H=-299.6kJ·mol-1
H2O(g) △H=-299.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1
由上述反应,可求出N2(g)+3H2(g)![]() 2NH3(g)的△H=___。
2NH3(g)的△H=___。
(2)对于反应①,在恒温恒容(H2O为气态)的容器中,下列选项表明反应已达到平衡的是___。
A.混合气体的平均摩尔质量不变
B.混合气体的密度不变
C.气体的颜色不再变化
D.体系内压强不再变化
E.每消耗1molNH3的同时生成1molNO2
(3)已知:N2(g)+3H2(g)![]() 2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
(4)如图为673K温度下,某合成氨塔里各气体组分压强变化图。
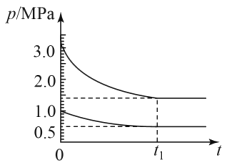
①t1平衡时,氨气的体积分数为___%(保留位小数)。
②在图中画出氨气组分压强变化图___。
③该温度下N2(g)+3H2(g)![]() 2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
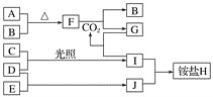
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组对金属钠进行研究。已知C、D都是单质,F的水溶液是一种常见的强酸。
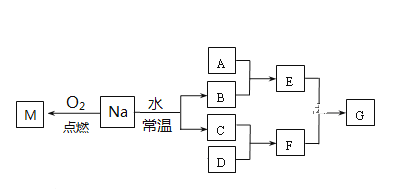
(1)金属Na在空气中放置足够长时间,最终的生成物是:______。
(2)若A是一种常见金属单质,且A与B溶液能够反应,写出该反应的化学方程式__________。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出白色絮状沉淀转变成红褐色沉淀过程发生化学反应的方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下10种化合物中,不能通过化合反应直接生成的有( )
①Fe3O4;②Fe(OH)3;③FeCl2;④CuS;⑤Cu2S;⑥Cu2(OH)2CO3;⑦Al(OH)3;⑧Na2CO3;⑨NaHCO3;⑩Na2O2
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西安兵马佣二号坑出土的宝剑因含有铬而锋利无比。目前,工业用硬铬尖晶石(属于含氧酸盐,主要含MN2O4其中M代表Mg或Fe,N代表Cr或Al)制备重铬酸钠(工业流程如图),同时电解重铬酸钠溶液便可得到铬。
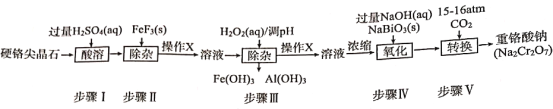
(1)硬铬尖晶石中,Cr的化合价为__。
(2)在步骤II中除去的离子是___,操作X的名称为___。
(3)写出步骤III中H2O2表现的性质是___,已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为___。(常温下:[Ksp[Cr(OH)3]=1.0×10-32,Ksp[Al(OH)3]=1.0×10-35,Ksp[Fe(OH)3]=1.0×10-38]。
A.10~11 B.>11 C.约为10 D.约为4
(4)已知NaBiO3和Bi(OH)3都是难溶于水的固体。在步骤IV中发生化学反应的离子方程式为___,步骤V中CO2压强越大Na2Cr2O7产率越高,其原因是___。
(5)工业上用电解法制备铬,其装置示意图如图:
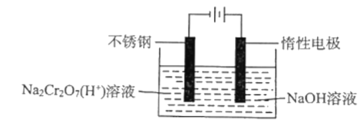
电解池工作时,阴极发生的电极反应式为___,该装置的电能主要转变为___能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
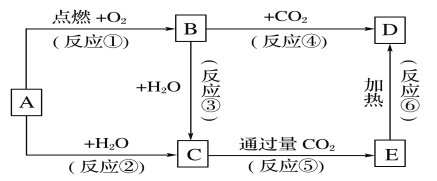
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com