
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
【答案】④②③①⑦④⑤⑧>c(Na+) =c(CH3COO-) >c(H+) =c( OH-)CH3COOHCH3COO-0.006
【解析】
(1)水在溶液中存在电离平衡H2O![]() H++OH- ,所以酸或碱均是抑制水的电离,如果氢离子浓度和OH― 如果相同,对水的电离抑制程度就相同的。盐的水解可以促进水的电离。硫酸是二元强酸,醋酸是一元弱酸,氢氧化钠是一元强碱,氯化铵溶于水存在水解平衡,所以由水电离出的H+ 浓度由大到小的顺序是④②③①;(2)氨水是弱碱部分电离,所以NH4+浓度最小。另外三种属于铵盐,NH4+ 水解显酸性,⑦中能电离出大量的氢离子,抑制其水解,⑤中阳离子和阴离子均水解,相互促进。所以溶液中NH4+浓度由大到小的顺序是⑦④⑤⑧;(3)②和③等体积混合后,二者恰好反应生成醋酸钠,醋酸钠水解显碱性,所以混合液中各离子浓度由大到小的顺序是c(Na + )> c(CH3COO- ) >c(OH-)>c(H+);(4)根据物料守恒可知,0.010mol CH3COONa在溶液中以CH3COOH和CH3COO-存在,n(CH3COOH)+n(CH3COO-)=0.010mol,故答案为:CH3COOH;CH3COO-;(2)溶液遵循电荷守恒,存在:n(H+)+n(Na+)=n(Cl-)+n(CH3COO-)+n(OH-),则n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。
H++OH- ,所以酸或碱均是抑制水的电离,如果氢离子浓度和OH― 如果相同,对水的电离抑制程度就相同的。盐的水解可以促进水的电离。硫酸是二元强酸,醋酸是一元弱酸,氢氧化钠是一元强碱,氯化铵溶于水存在水解平衡,所以由水电离出的H+ 浓度由大到小的顺序是④②③①;(2)氨水是弱碱部分电离,所以NH4+浓度最小。另外三种属于铵盐,NH4+ 水解显酸性,⑦中能电离出大量的氢离子,抑制其水解,⑤中阳离子和阴离子均水解,相互促进。所以溶液中NH4+浓度由大到小的顺序是⑦④⑤⑧;(3)②和③等体积混合后,二者恰好反应生成醋酸钠,醋酸钠水解显碱性,所以混合液中各离子浓度由大到小的顺序是c(Na + )> c(CH3COO- ) >c(OH-)>c(H+);(4)根据物料守恒可知,0.010mol CH3COONa在溶液中以CH3COOH和CH3COO-存在,n(CH3COOH)+n(CH3COO-)=0.010mol,故答案为:CH3COOH;CH3COO-;(2)溶液遵循电荷守恒,存在:n(H+)+n(Na+)=n(Cl-)+n(CH3COO-)+n(OH-),则n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的主要污染物是NO、NO2和CO。用NaOH溶液可吸收NO、NO2,当n(NO)﹕n(NO2)=1时只生成一种盐,这种盐的化学式为__________。
(2)金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | CrO2- | CrO42- |
颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:
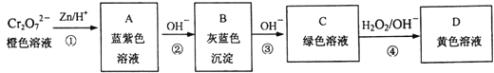
①写出反应④的离子方程式:______________________________________。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
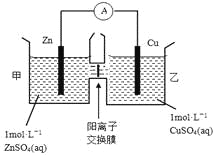
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
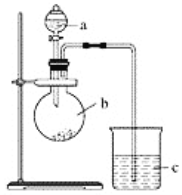
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的电子、质子和中子的基本数据,讨论回答问题:
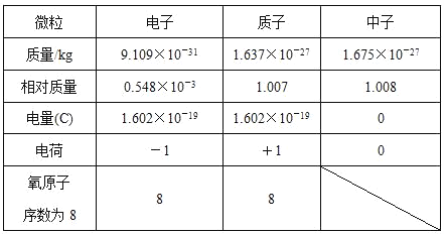
(1)决定原子质量的主要微粒是____________。
(2)原子相对质量的计算方法是_____________。
(3)如果1个质子和1个中子的相对质量都近似等于1,其原子的相对质量近似等于____________。
(4)原子中质子数、中子数、质量数之间的关系是_____。
(5)确定原子中质子数的方法是_________
(6)原子显电中性的原因是__________
(7)质子数为Z,质量数为A的X元素原子的组成符号是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
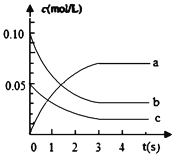
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.两个非金属原子间不可能形成离子键B.非金属元素不可能形成离子化合物
C.离子化合物中不可能有共价键D.共价化合物中可能有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com