
【题目】聚碳酸酯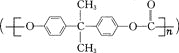 是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X
是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X![]() 与另一原料Y反应制得。下列说法不正确的是( )
与另一原料Y反应制得。下列说法不正确的是( )
A.该制备反应为缩聚反应
B.Y的分子式为C15H16O2
C.传统的合成方法原料X一般选用![]() ,则合成产物中必有大量HCl气体产生
,则合成产物中必有大量HCl气体产生
D.若将原料X选为CO2,在催化剂作用下实现理论原子利用率100%
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下用1L1mol·L-1Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法正确的是
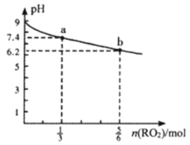
A.a点溶液中2c(Na+)=3c(RO32-)
B.向b点溶液中加水可使溶液的pH由6.2升高到7.4
C.常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D.当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“五水共治”是浙江治水的成功典范,其中含氮废水处理是污水治理的一个重要课题,图3是高含氰![]() 废水处理方案:
废水处理方案:
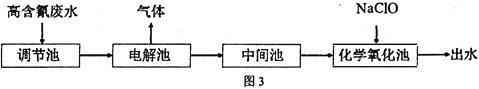
![]() 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:![]() ,请写出第二阶段的电极反应式________。
,请写出第二阶段的电极反应式________。
![]() 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将![]() 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在50~60℃下制备硝基苯的反应装置如图所示。下列有关说法错误的是( )
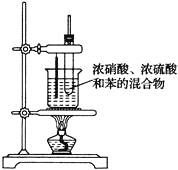
A.长玻璃导管的作用是冷凝回流、平衡压强
B.加入试剂的顺序:先加浓硝酸,再加浓硫酸,冷却后加入苯
C.将反应后的液体倒入烧杯中,加水
D.为了除去在硝基苯中的酸性物质,需要水洗、碱洗,然后再水洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO33H2O2)俗称固体双氧水。实验室可用碳酸钠和双氧水等为原料来制备,具体流程如下:

已知:①相关反应的方程式如下:2Na2CO3+3H2O2=2Na2CO33H2O2△H<0
②工业上常以产品活性氧的质量分数[ω(活性氧)=![]() ×100%]来衡量产品的优劣,13.00%以上为优等品。
×100%]来衡量产品的优劣,13.00%以上为优等品。
请回答:
表1 反应温度对产品收率及活性氧含量的影响
反应温度/℃ | 产品收率/% | 活性氧质量分数/% |
5 | 65.3 | 12.71 |
10 | 73.2 | 13.24 |
15 | 85.0 | 13.55 |
20 | 83.2 | 13.30 |
25 | 55.1 | 12.78 |
表2加料时间对产品收率及活性氧含量的影响
加料时间/min | 产品收率/% | 活性氧质量分数/% |
5 | 65.7 | 13.30 |
10 | 76.8 | 14.75 |
15 | 81.3 | 14.26 |
20 | 89.0 | 13.82 |
25 | 87.9 | 13.51 |
(1)分析表1,一般选择的反应温度为_____。
(2)分析表2,加料时间对产品收率也有很大影响,时间太短或太长均不利于生产,加料时间太短导致产品收率较低的原因是_____。
(3)结晶过程中加入氯化钠,作用是_____。
(4)下列关于抽滤操作,正确的是_____。
A.准备略大于漏斗内径的滤纸,以盖住布氏漏斗瓷板上的小孔
B.用倾析法先转移溶液,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,加入少量水并开大水龙头,重复操作2~3次
D.用玻璃棒轻轻刮下抽滤得到的固体,晾干后保存在试剂瓶中
(5)使用图2所示装置抽滤,中途需停止抽滤时,最佳操作为_____。
(6)产品出厂前需测定活性氧的质量分数,现将0.1000g某厂的产品(所含杂质均不参与反应)溶于水配成溶液,加入10.00mL1.000molL﹣1的稀硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量_____,用0.1000molL﹣1的Na2S2O3标准溶液滴定,若该产品的活性氧质量分数为13.60%,则达到滴定终点时共消耗标准液的体积为_____mL。[已知:2Na2S2O3+I2=Na2S4O6+2NaI]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是从复合花序植物黄花蒿中提取得到的一种有效的疟疾治疗药物。查阅资料知:常温下,青蒿素为无色针状晶体,味道较苦,难溶于水,易溶于有机溶剂,熔点为![]() ;从青蒿中提取青蒿素的方法主要有乙醚浸提法和溶剂汽油浸提法。
;从青蒿中提取青蒿素的方法主要有乙醚浸提法和溶剂汽油浸提法。
回答下列问题:
(一)用乙醚浸提法提取青蒿素的流程如下图:

(1)对青蒿进行破碎的目的是______。
(2)操作Ⅰ所用到的玻璃仪器是______,操作Ⅱ的仪器选择及安装都正确的是______(填标号)。
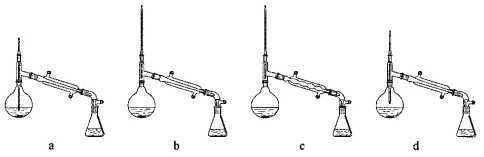
(3)操作Ⅲ的主要过程可能是______。
a.加水溶解,蒸发浓缩、冷却结晶
b.加95%乙醇,浓缩、结晶、过滤
c.加入乙醚进行萃取分液
(二)青蒿素分子式的测定
用如图所示的实验装置测定青蒿素的分子式,将28.2 g青蒿素放在燃烧管C中充分燃烧:
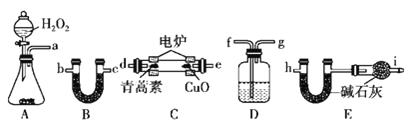
(4)①仪器各接口的连接顺序从左到右依次为______![]() 每个装置限用一次
每个装置限用一次![]() ;
;
②装置E中干燥管的作用是______;
③装置D中的试剂为______;
④已知青蒿素分子中只含碳、氢、氧三种元素,用合理连接后的装置进行实验,测量数据如表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素分子中碳、氢、氧三种原子的个数比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为_______________ ,Cr位于元素周期表第四周期____族。
(2)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K___Cr(填“<”或“>”);
(3)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为______________。
(4)Cr的一种配合物结构如图所示:
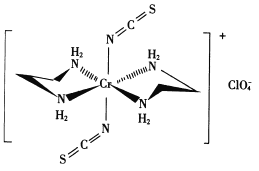
①阴离子C1O4-的空间构型为___________形。
②配离子中,中心离子的配位数为________。
(5)配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是_____________,分子中三种元素电负性从大到小的顺序为________________。
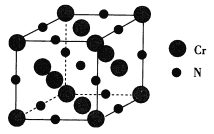
(6)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5.9 g·cm-3,阿伏加德罗常数的值为6.02×1023,则氮化铬的晶胞边长为_________________nm(列出计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com