
【题目】实验室在50~60℃下制备硝基苯的反应装置如图所示。下列有关说法错误的是( )
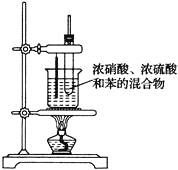
A.长玻璃导管的作用是冷凝回流、平衡压强
B.加入试剂的顺序:先加浓硝酸,再加浓硫酸,冷却后加入苯
C.将反应后的液体倒入烧杯中,加水
D.为了除去在硝基苯中的酸性物质,需要水洗、碱洗,然后再水洗
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
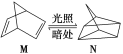
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4) 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1;CO(g)+l/2O2(g)=CO2(g)△H=-283. 0kJ mol-1;C(石墨)+O2(g)=CO2(g)△H=-393.5kJ mol-1。则4Fe (s)+3O2(g) =2Fe2O3(s)△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
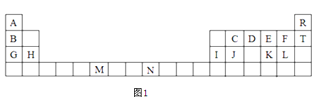
试回答下列问题:
(1)F-的结构示意图:__。
(2)D的气态氢化物的VSEPR模型为___,其中心原子的杂化类型为___,分子的空间构型为___。
(3)G、H和I的第一电离能数值由大到小的顺序为:___(用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有____(填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___(填分子式)。
(5)已知元素N可形成一种红紫色配合物,其组成为NCl3·5NH3·H2O。该配合物中的中心离子N离子在基态时核外简化电子排布式为___,又已知中心离子N离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是___。
(6)过去常以JE2为催化剂的载体。JE2的晶胞可作如下推导:先将NaCl晶胞中的所有Na+去掉,并将Cl-全部换成J原子,再在每两个不共面的“小立方体”中心处各放置一个J原子便构成了晶体J的一个晶胞,则一个J的晶胞中有___个J原子,再在每两个相邻的J原子(距离最近的两个J原子)中心连线的中点处增添一个E原子,便构成了JE2晶胞,故JE2晶胞中有___个E原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,![]() 某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为
某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为![]() ;若用足量碱石灰吸收燃烧产物,则碱石灰增重
;若用足量碱石灰吸收燃烧产物,则碱石灰增重![]() 。
。
(1)计算燃烧产物中水的质量_____________。
(2)若原气体是单一气体,通过计算推断它的分子式___________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式________________(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A具有如下性质:
的有机物A具有如下性质:![]() 在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;
在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;![]() 在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;
在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;![]() 在浓硫酸作用下,能生成一种分子式为
在浓硫酸作用下,能生成一种分子式为![]() 的五元环状化合物E。下列叙述正确的是
的五元环状化合物E。下列叙述正确的是 ![]()
![]()
A.A的结构简式为![]()
B.C与D互为同系物
C.A转化为B的反应属于取代反应
D.B与E互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯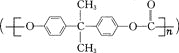 是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X
是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X![]() 与另一原料Y反应制得。下列说法不正确的是( )
与另一原料Y反应制得。下列说法不正确的是( )
A.该制备反应为缩聚反应
B.Y的分子式为C15H16O2
C.传统的合成方法原料X一般选用![]() ,则合成产物中必有大量HCl气体产生
,则合成产物中必有大量HCl气体产生
D.若将原料X选为CO2,在催化剂作用下实现理论原子利用率100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O △H<0;回答下列问题:
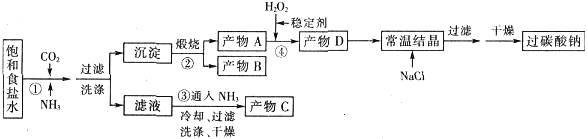
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
(2)反应①应先通入的气体是__________。写出反应①的化学方程式 (写总反应)
(3)加入NaCl的作用是 。
(4)该生产流程中可循环使用的物质是___________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作名称是___________;进行该操作的方法是 。
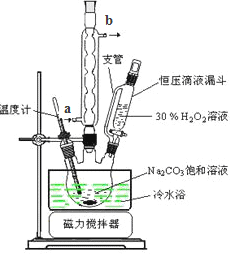
(6)实验室利用右图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
T/℃ | 活性氧百分含量 | 产率 |
5~10 | 13.94 | 85.49 |
10~15 | 14.02 | 85.78 |
15~20 | 15.05 | 88.38 |
20~25 | 14.46 | 83.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图结构的有机物的下列叙述中,不正确的是

A.常温下,能与Na2CO3溶液反应放出CO2气体
B.能发生碱性水解,lmol该有机物完成反应最多需消耗8molNaOH
C.与稀硫酸共热,生成两种有机物
D.该有机物的化学式是C14H10O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB由碳、氢、氧三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺荷生物,应用于临床化验、法医检验、刑事侦破及环境监测等领域,某研究小组欲利用燃绕法测定TMB的分子式(氮元素转化为N2),实验装置如图所示。回答下列问题:

(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是_______。仪器a的名称是__________________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是_________________。
(3)装置C中CuO粉末的作用为_________________________。
(4)该实验_______(填“需要”或”不需要”)尾气处理,其原因是_________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结東时测得D增加3.60g,E增加14.08g,则TMB的分子式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com