
【题目】CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14
C. 13∶8∶29 D. 13∶16∶57
【答案】C
【解析】
同温同压下,气体摩尔体积相等,根据ρ=
M
Vm
知,CO2、H2和CO组成的混合气体平均摩尔质量与氮气摩尔质量相等,M(N2)=M(CO)=28g/mol,所以混合气体平均摩尔质量与CO多少无关,则CO2、H2的平均摩尔质量为28g/mol,根据M=![]() 计算、V=nVm进行计算。
计算、V=nVm进行计算。
同温同压下,气体摩尔体积相等,根据ρ=![]() 知,CO2、H2和CO组成的混合气体平均摩尔质量与氮气摩尔质量相等,M(N2)=M(CO)=28g/mol,所以混合气体平均摩尔质量与CO多少无关,则CO2、H2的平均摩尔质量为28g/mol,设CO2、H2的物质的量分别是x、y,平均摩尔质量M=
知,CO2、H2和CO组成的混合气体平均摩尔质量与氮气摩尔质量相等,M(N2)=M(CO)=28g/mol,所以混合气体平均摩尔质量与CO多少无关,则CO2、H2的平均摩尔质量为28g/mol,设CO2、H2的物质的量分别是x、y,平均摩尔质量M=![]() g/mol=28g/mol,x:y=13:8,根据V=nVm知,相同条件下,不同物质的量的气体体积之比等于其物质的量之比,所以三种气体的体积之比可以是13:8:29,答案选C。
g/mol=28g/mol,x:y=13:8,根据V=nVm知,相同条件下,不同物质的量的气体体积之比等于其物质的量之比,所以三种气体的体积之比可以是13:8:29,答案选C。


科目:高中化学 来源: 题型:
【题目】为了使城市生活垃圾得到合理利用,减少垃圾的填埋量,近年来步实施了生活垃圾分类投放的办法。其中废旧塑料袋、废旧报纸和纸箱、废旧衣物等属于
A. 纯净物 B. 氧化物 C. 有机物 D. 非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离于方程式正确的是
A. 向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C. 酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O
D. 向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“铜都”安徽铜陵有许多黄铜矿(主要成分为CuFeS2,含少量Al2O3、SiO2),黄铜矿是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)火法炼铜首先要焙烧黄铜矿,其反应原理为2CuFeS2+O2![]() Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,若反应中转移0.3mol电子时,则标准状况下,产生SO2的体积为________L。
Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,若反应中转移0.3mol电子时,则标准状况下,产生SO2的体积为________L。
(2)焙烧黄铜矿产生的Cu2S可被稀硝酸氧化为Cu2+ 和硫单质,HNO3的还原产物为NO,试写出Cu2S与稀硝酸反应的离子方程式,并用双桥式表示电子转移__________________。
(3)焙烧黄铜矿还可得到Cu2O,将21.6g Cu2O加入到500mL某浓度的稀硝酸中,固体物质完全反应,生成Cu(NO3)2和NO,在所得溶液中加入1.0molL-1的NaOH溶液1.0L,此时溶液呈中性。原硝酸的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。已知:
![]() 。
。
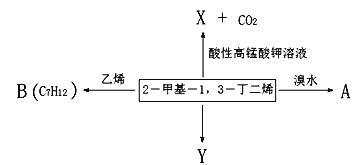
请回答下列问题:
(1)2-甲基-1,3-丁二烯与溴水发生加成反应。
①完全加成所得有机产物的名称____________;
②发生1,2-加成所得有机产物的结构简式为_______________________;
③发生1,4-加成反应的化学方程式为_______________________________________。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________。
(3)Y(![]() )是天然橡胶的主要成分。能发生的反应有_________(填标号)。
)是天然橡胶的主要成分。能发生的反应有_________(填标号)。
A.加成反应 B.氧化反应 C.消去反应 D.酯化反应
(4)X的分子式为C3H4O3,其结构简式为_________________;X与乙醇发生酯化反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑灰的主要成分是硫化钡(BaS),常用于制取氧化钡等钡盐。
I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62-)。
步骤5....
步骤6数据处理,计算黑灰中BaS含量。
(1)步骤2实验中所需的玻璃仪器有烧杯、漏斗.500mL容量瓶、_______。
(2)步骤4到达滴定终点时,滴定管中液面如图所示,此时滴定管读数为____mL。若盛装Na2S2O3标准溶液的滴定管未润洗,则所测得的BaS含量将会_______(填“偏高”、“偏低"或“不变”)。

(3)为保证实验结果的准确性,步骤5应为_______________。
II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
(1)酸性矿井水(主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为_______________。
(2)查阅资料发现铁元素的存在对SO2含量(mg/L)的测定结果影响较大。请补充完整测定酸性矿井水中SO42-含量的实验步骤:量取一定体积的酸性矿井水,________,根据采集的数据计算废水中SO42-含量。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/LBaCl2溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A. ①②③⑥ B. ①②④⑤ C. ①②⑤⑥ D. ③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com