
| 消耗量 |
| 起始量 |
| △c |
| △t |
| △c |
| △t |
| SO3的量 |
| 气体总量 |
| 0.15mol/L |
| 0.25mol/L |
| 0.3mol/L |
| 10min |
| 0.15mol/L |
| 10min |
| 0.2 |
| 0.2+0.1+0.3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.5mol?L-1 MgCl2溶液 |
| B、200mL 0.25mol?L-1 AlCl3溶液 |
| C、50mL 1mol?L-1 NaCl溶液 |
| D、25mL 0.5mol?L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钙 熟石灰 CaO |
| B、碳酸钙 生石灰 CaCO3 |
| C、氯化钠 食盐 NaCl |
| D、汞 水银 Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 事实 | 解释 |
| A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
| B | C2H5OH与浓硫酸170℃共热,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
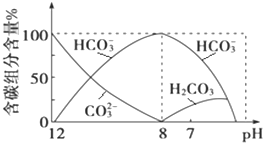 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-).c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
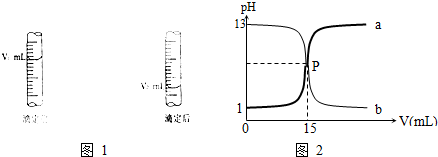
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com