
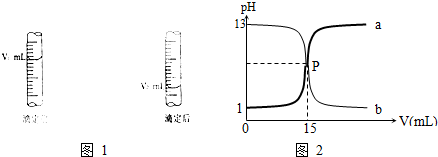
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(HCl)×V(HCl) |
| V(NaOH) |
| (V2-V1)×a |
| V |
| c(HCl)×V(HCl) |
| V(NaOH) |
| (V2-V1)×a |
| V |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Fe3+ | Cu2+ | Zn2+ |
| 完全沉淀时的pH | 3.2 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu中混有CuO,可以通过加入足量盐酸溶液,再过滤、洗涤、干燥可得到洁净的Cu |
| B、把1 mL饱和FeCl3溶液逐滴加入到20 mL的沸水中,边加边搅拌,加热到沸腾即可得Fe(OH)3胶体 |
| C、蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

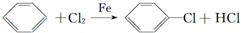
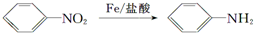 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)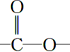 结构.
结构.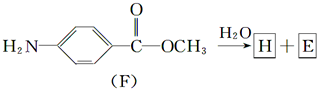
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com