
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
| 0.01mol/L×0.020L |
| 2×0.020L |
| 0.0001mol |
| 0.01L |
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |


科目:高中化学 来源: 题型:
| A、常温常压下,56g乙烯和丙烯的混合气中含有的碳原子数为4NA |
| B、156g Na2O2固体与足量的二氧化碳反应时,转移的电子数为4NA |
| C、将1.06克Na2CO3固体溶于水,溶液中含CO32-数目为0.01NA |
| D、标准状况下,向溶有2.24LSO2的水溶液中,通入3.36LCl2,转移电子数目0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 事实 | 解释 |
| A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
| B | C2H5OH与浓硫酸170℃共热,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
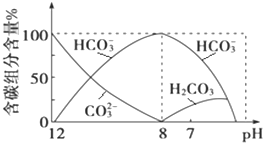 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-).c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
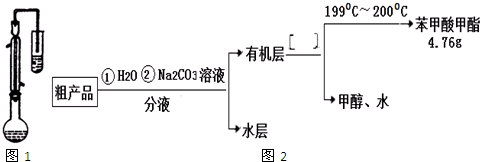
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
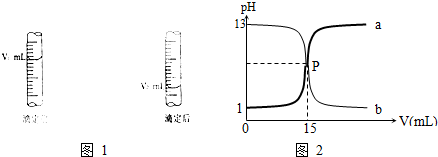
查看答案和解析>>
科目:高中化学 来源: 题型:
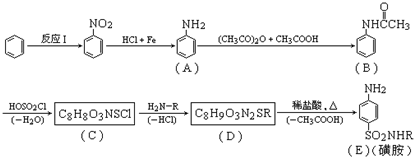
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com