
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| B | 向均盛有2mL5% H2O2 溶液的两支试管中分别滴入0.2mol•L-1 FeCl3,和0.3mol.L-1CuCl2 溶lmL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象. | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,若二者混合生成醋酸铵,溶液为中性,可知二者电离程度相同;
B.其它条件相同,FeCl3、CuCl2 只有金属阳离子不同;
C.Mg与醋酸反应放热,后来氢离子浓度减小;
D.强酸制取弱酸的反应可观察到现象.
解答 解:A.常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,若二者混合生成醋酸铵,溶液为中性,可知二者电离程度相同,则常温下,醋酸和氨水的电离平衡常数相等,故A正确;
B.其它条件相同,FeCl3、CuCl2 只有金属阳离子不同,前者生成气泡的速率更快,则催化效果:Fe3+>Cu2+,故B正确;
C.Mg与醋酸反应放热,后来氢离子浓度减小,则产生气泡的速率会先加快再减慢,不能说明反应刚开始时,醋酸电离平衡正移,c(H+)增大,且温度影响反应速率,故C错误;
D.观察到明显无现象可知二者不反应,则H3BO3的酸性弱于H2CO3,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合及实验评价性分析,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移 | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 用浓盐酸酸化KMnO4溶液以增强其氧化性 | |
| D. | 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 0.1 mol/L | D. | 1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
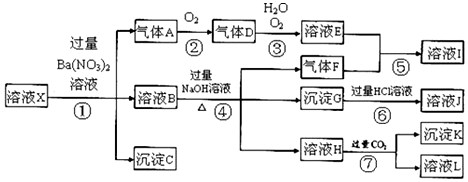
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: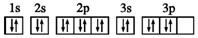 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com