
【题目】根据下列原电池的装置图,回答问题:
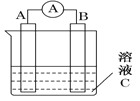
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则负极A极材料为 ,正极B极材料为 ,溶液C为 。
(3)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:
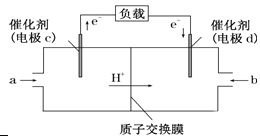
①则d电极是________(填“正极”或“负极”),c电极的反应方程式为:_____ 。
②若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
【答案】(1) 2H++2e-===H2↑ 升高
(2)Cu石墨(或比铜活泼性弱的金属) 含Fe3+的溶液
(3)①正 CH4-8e-+2H2O===CO2+8H+ ②11.2
【解析】
试题分析:(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,电极反应为Fe-2e-=Fe2+,A为正极,溶液中氢离子得到电子生成氢气,电极反应为2H++2e-===H2↑;氢离子浓度减小,氢氧根离子浓度增大,溶液PH升高;
(2)将反应Cu+2Fe3+===Cu2++2Fe2+设计成上图所示的原电池装置,Cu元素的化合价由0价升高到+2价,失电子作原电池的负极,则负极A极材料为Cu,正极B极材料为石墨,Fe3+在正极得电子发生还原反应,溶液C用可溶性铁盐,即含Fe3+的溶液。
(3)①根据甲烷燃料电池的结构示意图可知,电子流出的电极为负极,c为负极,d为正极,在燃料电池中,氧气在正极得电子发生还原反应,甲烷在负极失电子发生氧化反应,所以c电极的反应方程式为CH4-8e-+2H2O===CO2+8H+。
②根据正极电极反应式:O2+4e-+4H+=2H2O,则线路中转移2 mol电子时,消耗的O2为0.5mol,在标况下的体积为0.5mol×22.4L/mol=11.2L。


科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( )
A.钠在氧气中燃烧,钠的氧化产物:![]()
B.铁在Cl2中燃烧,铁的氧化产物:![]()
C.A1C13溶液中滴加NaOH溶液后体系中铝元素的存在形式:![]()
D.FeI2溶液中通入Cl2,铁元素存在形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是
A. 烧菜用过的铁锅,经放置常出现红棕色斑迹
B. 用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C. 牛奶久置变质腐败
D. 用醋酸除去水垢[主要成分是CaCO3、Mg (OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于镁的性质叙述正确的是( )
A.能在空气中燃烧,但不能在二氧化碳中燃烧
B.不能与氮气发生反应
C.不与冷水反应,但与热水反应
D.可用电解氯化镁溶液的方法来制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
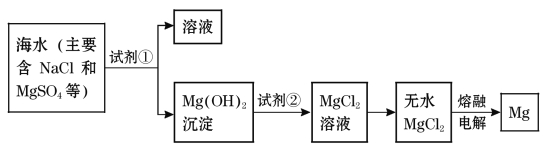
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用___________,要使MgSO4完全转化为沉淀,加入试剂①的量应_________________;
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_______________;
(3)试剂②可以选用___________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为![]() ,该元素的名称是 ;
,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJmol﹣1 I1 I2 I3 I4
X 578 1 817 2 745 11 578
Y 738 1 451 7 733 10 540
Z 496 4 562 6 912 9 543
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键(填“极性”或“非极性”)的 分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB﹣离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为 .
②G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,测得其浓度为2mol/L和1mol·L-1;且发生如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是( )
4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡表达式为:K= 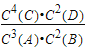
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变.
④增加C的量,A、B转化率不变
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com