
����Ŀ����1����֪X��Y��ZΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���
������/kJmol��1 I1 I2 I3 I4
X 578 1 817 2 745 11 578
Y 738 1 451 7 733 10 540
Z 496 4 562 6 912 9 543
��X��Y��Z�ĵ縺�ԴӴ�С��˳��Ϊ ����Ԫ�ط��ű�ʾ����Ԫ��Y�ĵ�һ�����ܴ���X�ĵ�һ������ԭ���� ��
��2��A��B��C��D�����ڱ���ǰ10��Ԫ�أ����ǵ�ԭ�Ӱ뾶���μ�С��D�ֱܷ���A��B��C�γ�XYn�͵ĵ���������ȵķ���M��N��W������M��N��W�����У�A��B��C ��ԭ�Ӷ���ȡsp3�ӻ���
��A��B��C�ĵ�һ��������С�����˳��Ϊ ����Ԫ�ط��ű�ʾ����
��M�Ǻ��� ��������ԡ��Ǽ��ԡ����� ���ӣ�����ԡ��Ǽ��ԡ�����
��N��һ����Һ�������壬���������Һ����ԭ�� ��
��W���ӵ�VSEPRģ�͵Ŀռ乹��Ϊ ��W���ӵĿռ乹��Ϊ ��
��AB�������к�B2���ӵĦм���Ŀ��Ϊ ��
��3��E��F��G��Ԫ�ص�ԭ����������������ԭ�ӵĺ�������������Ų���Ϊ4s1��
��FԪ�����仯����������ϼ�Ϊ ��
��G2+���ӵĺ�������Ų�ʽΪ ��G2+��N�����γɵ������ӵĽṹʽΪ ��
���𰸡���1��Al��Mg��Na����ΪԪ��Mg�۵����Ų�ʽΪ3s2��ȫ����״̬����Al�ȶ���
��2����C��O��N��
�ڼ��ԣ��Ǽ��ԣ�
�۰����Ӽ��������������Һ����
���������ͣ�V�Σ�
��1��1��
��3����+6��
��1s22s22p63s23p63d9�� ��
��
��������
�����������1��X��Y��ZΪ��������Ԫ�أ�X��I4������ͻȻ����˵���������3�����ӣ���XӦΪAl��Y��I3������ͻȻ����˵���������2�����ӣ���YӦΪMg��Z��I2������ͻȻ����˵���������1�����ӣ���ZӦΪNa��ͬ����Ԫ�ش�����Ԫ�صĵ縺������ǿ��Mg�۵����Ų�ʽΪ3s2��ȫ����״̬����Al�ȶ�������Mg�ĵ�һ�����ܴ���Al��
��2��A��B��C��D�����ڱ���ǰ10��Ԫ�أ����ǵ�ԭ�Ӱ뾶���μ�С��D�ֱܷ���A��B��C�γ�XYn�͵���������ȵķ���M��N��W������M��N��W�����У�A��B��C ��ԭ�Ӷ���ȡsp3�ӻ�����A��B��C��D�ֱ�Ϊ̼�����������⣬MΪCH4��NΪNH3��WΪH2O��
��ͬ������ԭ����������һ�����ܳ��������ƣ�NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ�
��ͬ��Ԫ��֮���γɷǼ��Թ��ۼ�����ͬԪ��֮���γɼ��Թ��ۼ����������Ϊ�������幹�ͣ�������������������غϣ�
�۰����Ӽ���������
��WΪH2O������Oԭ�Ӽ۲���Ӷ������µ��Ӷ�����ȷ��VSEPRģ�͵Ŀռ乹�͡����ӵĿռ乹�ͣ�
��CN�������к�N2�����к���������������2���м���
��3��E��F��G��Ԫ�ص�ԭ����������������ԭ�ӵĺ�������������Ų���Ϊ4s1����EΪK��FΪCr��GΪCu��
�⣺��1��X��Y��ZΪ��������Ԫ�أ�X��I4������ͻȻ����˵���������3�����ӣ���XӦΪAl��Y��I3������ͻȻ����˵���������2�����ӣ���YӦΪMg��Z��I2������ͻȻ����˵���������1�����ӣ���ZӦΪNa��
ͬ����Ԫ�ش����ҵ縺������ǿ����X��Y��Z�ĵ縺�ԴӴ�С��˳��ΪAl��Mg��Na����ΪԪ��Mg�۵����Ų�ʽΪ3s2��ȫ����״̬����Al�ȶ�������Mg�ĵ�һ�����ܴ���Al��
�ʴ�Ϊ��Al��Mg��Na����ΪԪ��Mg�۵����Ų�ʽΪ3s2��ȫ����״̬����Al�ȶ���
��2��A��B��C��D�����ڱ���ǰ10��Ԫ�أ����ǵ�ԭ�Ӱ뾶���μ�С��D�ֱܷ���A��B��C�γ�XYn�͵���������ȵķ���M��N��W������M��N��W�����У�A��B��C ��ԭ�Ӷ���ȡsp3�ӻ�����A��B��C��D�ֱ�Ϊ̼�����������⣬MΪCH4��NΪNH3��WΪH2O��
��ͬ������ԭ����������һ�����ܳ��������ƣ�NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ�����ܣ�C��O��N���ʴ�Ϊ��C��O��N��
��MΪ���飬���麬��C��H���Թ��ۼ������ӹ���Ϊ�������壬������������������غϣ����ڷǼ��Է��ӣ��ʴ�Ϊ�����ԣ��Ǽ��ԣ�
��NΪ������Ϊ�����Ӽ��������������Һ�����ʴ�Ϊ�������Ӽ��������������Һ����
��WΪH2O������ԭ����ԭ�Ӻ��й¶Ե���Ϊ![]() =2���۲���Ӷ���Ϊ4����ˮ���ӵ�VSEPRģ�͵Ŀռ乹��Ϊ�����壬ˮ���ӵĿռ乹��ΪV�Σ��ʴ�Ϊ���������ͣ�V�Σ�
=2���۲���Ӷ���Ϊ4����ˮ���ӵ�VSEPRģ�͵Ŀռ乹��Ϊ�����壬ˮ���ӵĿռ乹��ΪV�Σ��ʴ�Ϊ���������ͣ�V�Σ�
��CN�����Ӻ�N2�����о������������м���Ŀ��Ϊ2��2=1��1���ʴ�Ϊ��1��1��
��3��E��F��G��Ԫ�ص�ԭ����������������ԭ�ӵĺ�������������Ų���Ϊ4s1����EΪK��FΪCr��GΪCu��
�ٸ�Ԫ�صļ۵����Ų�ʽΪ3d54s1�����仯����������ϼ�Ϊ+6�ۣ��ʴ�Ϊ��+6��
��Cu2+���ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d9��Cu2+��NH3�����γɵ�������Ϊ[Cu��NH3��4]2+����ṹʽΪ ��
��
�ʴ�Ϊ��1s22s22p63s23p63d9�� ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ˮ����ˮ��Һ�Լ��Ե��ǣ� ��
A. NH3 B. HCl C. SO2 D. CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ԭ��ص�װ��ͼ���ش����⣺
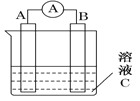
��1����CΪϡH2SO4��Һ��������ָ�뷢��ƫת��B�缫����ΪFe������������A�缫�Ϸ����ĵ缫��ӦʽΪ____________________����Ӧ����һ��ʱ�����ҺC��pH��________������ߡ������͡��������䡱����
��2�����轫��Ӧ��Cu��2Fe3��===Cu2����2Fe2����Ƴ�����ͼ��ʾ��ԭ���װ�ã���A������Ϊ ������B������Ϊ ����ҺCΪ ��
��3����CH4��O2����γɵ����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ���£�
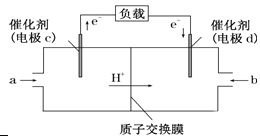
����d�缫��________�������������������c�缫�ķ�Ӧ����ʽΪ��_____ ��
������·��ת��2 mol���ӣ�������ȼ�ϵ�أ����ĵ�O2�ڱ���µ����Ϊ______ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ���������ȡ��IJ������̣�����ѡ�ò���ȷ���ǣ� ��
A����ȡ3g���ҵĸɺ�������������ƽ
B�����ոɺ�������ȫ��ɻҽ�����������
C��������к�ĺ�����ˮ���Һ����©��
D�������Ȼ�̼��������ĺ����ҽ�ȡҺ����ȡ�⩁����Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к���Ԫ�ء��Ӻ�������ȡ��Ԫ�������в��裺������Һ��ͨ������Cl2�������������ճɻҺ��ˮ���裻����CCl4�����÷�Һ©����Һ�������ˡ������IJ���˳������ ��
A���ڢݢ٢ۢ� B���٢ۢݢڢ� C���٢ڢۢܢ� D���ڢ٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO | |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 | |
�ش��������⣺
(1)�����������ӽ�����ӵ������ɴ�С��˳����________________��(����)
a��CO32- b��ClO- c��CH3COO- d��HCO3-��
(2)���з�Ӧ���ܷ�������__________
A��CO32- + CH3COOH = CH3COO- + CO2 �� + H2O
B��ClO- + CH3COOH = CH3COO- + HClO
C��CO32- + HClO = CO2 �� + H2O + ClO-
D��2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)������ˮϡ��0.10 mol��L-1�Ĵ���,�����и�ʽ��ʾ����ֵ��ˮ�������Ӷ��������__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
(4)���Ϊ10 mL pH��2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1 000 mL��ϡ����pH�仯 ��ͼ����HX�ĵ���ƽ�ⳣ��________(����ڡ��������ڡ���С�ڡ�)�����ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c(H��)________������Һ��ˮ���������c(H��)(����ڡ��������ڡ���С�ڡ�)
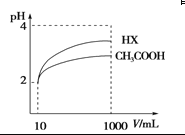
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����º��ݵ��ܱ������з������·�Ӧ��2A��g��+B��s��C��g��+3D��g��������˵���÷�Ӧ�ﵽƽ������� ��
A����������������
B����������ܶȲ���
C����Ӧ��B��Ũ�Ȳ���
D���������ƽ����Է����������ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�����ݳɷֲ�ͬ��Ϊƶ��������ƶ���м���ĺ����϶࣬���������顢���顢����ĺ�����Ը�һЩ����Ҫ������Һ��������˵����ȷ����
A��ƶ����Һ�� B��������Һ��
C������Һ��������ͬ D����ѹ���¾�����������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B�����������ǵ������ͬ����Լ��85.7%��̼����A������������ܶ���28����Bʽ������A��һ�뱶����A��B����ʹ������Ȼ�̼��Һ��ɫ����������ʵ����ʵ�ش����⣮
��1���ƶ�A��B�����Ļ�ѧʽ��
A ��B ��
��2��A��B�� ����A��B�Ľṹ��ʽ������ͬ���칹�壬ͬ���칹��������� ����дһ����
��3��д��B��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com