
【题目】海带中含碘元素。从海带中提取碘元素有下列步骤:①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是( )
A.②⑤①③④ B.①③⑤②④ C.①②③④⑤ D.②①③⑤④
科目:高中化学 来源: 题型:
【题目】课外实践活动中取某地石灰石样品12g进行探究实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
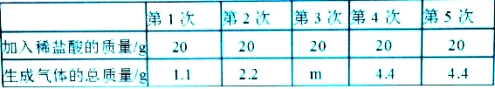
试求:(1)m的值为
(2)12g石灰石样品中碳酸钙的质量
(3)反应完全后最终溶液中氯化钙的质量分数?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于镁的性质叙述正确的是( )
A.能在空气中燃烧,但不能在二氧化碳中燃烧
B.不能与氮气发生反应
C.不与冷水反应,但与热水反应
D.可用电解氯化镁溶液的方法来制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为![]() ,该元素的名称是 ;
,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJmol﹣1 I1 I2 I3 I4
X 578 1 817 2 745 11 578
Y 738 1 451 7 733 10 540
Z 496 4 562 6 912 9 543
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键(填“极性”或“非极性”)的 分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB﹣离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为 .
②G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
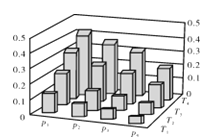
A. P1>P2>P3>P4
B. 甲醇的物质的量分数越高,反应的平衡常数越大
C. 若T1> T2> T3>T4,则该反应为放热反应
D. 缩小容积,可以提高CH3OH在混合物中的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 1molL-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)
生成CaCO3 | 溶液中HCO3- | H2 | 转移的电子 | |
A | 0.1NA | 0.1NA | ||
B | 1.12L | 0.1NA | ||
C | 10g | 0.05NA | ||
D | 10g | 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物在生产生活中扮演着重要的角色,研究有机物具有重要的意义。
【资料】乙烯的比例模型如下图所示。实验测得乙烯中碳碳双键的键能(键能是指断开1 mol化学键所需的能量)是615 kJ/mol,乙烷中碳碳单键的键能是348 kJ/mol。只需要较少的能量,就能使双键里较弱的一个键断裂, 这是乙烯的化学性质较活泼,容易发生加成反应等的原因。常温下乙烯易被 氧化剂氧化,如将乙烯通入酸性KMn04溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳。

Ⅰ.参考上述资料,结合已学知识,回答下列问题。
(1)乙烯的结构式是.
(2)下列说法中不正确的是 (填序号)
A.氯乙烯(CH2=CHCl)中六个原子在同一个平面上
B.乙稀分子中的碳碳双键是两条相同的碳碳单键
C.长途运输水果时,可用酸性高锰酸钾溶液吸收水果释放的乙烯,以保持水果新鲜
D.除去乙烷中的乙烯,可以选用酸性高锰酸钾溶液
(3)实验室制取的乙烯中混有SO2等气体杂质。下列试剂中,可用于检验乙烯中混有的SO2的是 (填序号)
A.溴水 B.酸性高锰酸钾溶液 C.品红溶液
Ⅱ.已知乙烯能发生以下转化
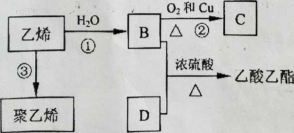
(1) D物质所含官能团的名称是 。
(2)反应②(B—C)的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com