
����Ŀ����������������Ʊ��������ʼ���ʵ�����£���ش��������⡣
(1)д���Ʊ�������������Ļ�ѧ����ʽ______________________��
(2)�Ʊ�ʵ�������ȡһС�ձ�����25 mL����ˮ���������ڣ����ˮ����μ���1��2 mL____________�����������________________��ֹͣ���ȡ�
(3)֤�������������������ɵ�ʵ�������__________________________________��
(4)�������������ȶ����ڵ���Ҫԭ����____________________________��
(5)�������������������Ȼ�����Һ��ʵ�������______________________��
(6)��ȡ�����ƵõĽ�������Թ��У������������Һ��������______________�����������Ϊ�����________________��
���𰸡�FeCl3��3H2O![]() Fe(OH)3(����)��3HCl�Ȼ���������Һ���Һ�ʺ��ɫ��һ���ɼ���ͨ���Ƶõ�Һ�壬�Ӳ���۲쵽һ����������ͨ·����˵���Ƶõ��ǽ������������������Ӵ��е�ɷ�ɢ����ֱ���Ĵ�С��ͬ�������ɫ�����۳�
Fe(OH)3(����)��3HCl�Ȼ���������Һ���Һ�ʺ��ɫ��һ���ɼ���ͨ���Ƶõ�Һ�壬�Ӳ���۲쵽һ����������ͨ·����˵���Ƶõ��ǽ������������������Ӵ��е�ɷ�ɢ����ֱ���Ĵ�С��ͬ�������ɫ�����۳�
��������
(1). �������������Ʊ��Ļ�ѧ����ʽΪFeCl3��3H2O![]() Fe(OH)3(����)��3HCl (2)�������������Ʊ������ˮ�м����Ȼ���������Һ��������е���Һ���ֺ��ɫֹͣ���ȼ��ɡ�(3).�����ж����ЧӦ�����Կ�����һ���ɼ���ͨ���Ƶõ�Һ�壬�Ӳ���۲쵽һ����������ͨ·����˵���Ƶõ��ǽ��塣 (4). ���������������Ӵ��е�ɣ�ʹ�������Ӳ��ܾۼ��ɸ���Ŀ������Ƚ��ȶ����ڡ� (5)�������Һ�ı�������Ϊ��ɢ����ֱ���Ĵ�С��ͬ�� (6)�������������м�������淋������Һ���ᷢ���۳������������ɫ������
Fe(OH)3(����)��3HCl (2)�������������Ʊ������ˮ�м����Ȼ���������Һ��������е���Һ���ֺ��ɫֹͣ���ȼ��ɡ�(3).�����ж����ЧӦ�����Կ�����һ���ɼ���ͨ���Ƶõ�Һ�壬�Ӳ���۲쵽һ����������ͨ·����˵���Ƶõ��ǽ��塣 (4). ���������������Ӵ��е�ɣ�ʹ�������Ӳ��ܾۼ��ɸ���Ŀ������Ƚ��ȶ����ڡ� (5)�������Һ�ı�������Ϊ��ɢ����ֱ���Ĵ�С��ͬ�� (6)�������������м�������淋������Һ���ᷢ���۳������������ɫ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ���ܴ���������ǣ� ����
A. ��ǿ����Һ�У�Na+��K+��AlO2����CO32��
B. ��pH=0����Һ�У�K+��Fe2+��Cl����NO3��
C. �ں�����Fe3+����Һ�У�NH4+��Na+��Cl����SCN��
D. ��c��H+��=10��13mol/L����Һ�У�NH4+��Al3+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԡ����ʵ�����Ϊ���ĵļ����ǻ�ѧ����Ļ����������롰���ʵ�������صļ�����ȷ����(����)
A. ����CO��CO2��O3�������壬���Ƿֱ���1 mol O����������������ʵ���֮��Ϊ3��2��1
B. 28 g CO��22.4 L CO2�к��е�̼ԭ����һ�����
C. ��״���£�11.2 L X������ӵ�����Ϊ16 g����X�����Ħ��������32
D. a g Cl2����b����ԭ�ӣ����ӵ�����NA����ֵ�ɱ�ʾΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼������Ҫ���ڲʵ�����ܵ�ӫ�����������ֲ����ȵ����죬ͨ��������ʯ��(��Ҫ�ɷ�ΪSrSO4�������б�������)�Ʊ����Ʊ�������ͼ��ʾ��
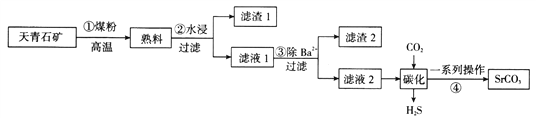
��֪��i�����ڡ���Һ1������Һ2���о���Ҫ��Sr(HS)2��Sr(OH)2��ʽ����
ii��SrSO4��BaSO4��KSP�ֱ���3.2��10-7��1.0��10-10
�ش��������⣺
(1)����ٷ�Ӧ��SrSO4+2C![]() SrS+2CO2�������ڱ�״���²���3.36 LCO2����ת�Ƶ�����Ϊ__________________��
SrS+2CO2�������ڱ�״���²���3.36 LCO2����ת�Ƶ�����Ϊ__________________��
(2)д��������С�ˮ������Ҫ��Ӧ�Ļ�ѧ����ʽ��________________________������ڡ����ˡ�������Ҫ����Ҫ��������Ϊ________________________��
(3)�����������յ��ŵ��������á��ɱ��ͣ����ӻ����Ƕȿ��Ǹù��������������Ե�ȱ����______________________________________________________��
(4)������Sr2+��Ba2+�ġ���Һ1���еμ�ϡ���ᣬ�����ֳ�������ʱ��c(Sr2+)��c(Ba2+)=________________��
(5)д����̼���������з�����Ӧ�Ļ�ѧ����ʽ��_______________________________��
(6)ij������ҵ��a kg������ʯ��(��SrSO4��40��)�Ʊ������յõ�b kg̼���Ȳ�Ʒ������Ϊ______________(�ú�a��b��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���пƴ������˹��ϳɽ��ʯ���·���,��ѧԭ��Ϊ��Na+CO2![]() C(���ʯ)+C(ʯī)+Na2CO3(δ��ƽ),���ֺϳɾ�����Զ�����塣����˵������ȷ����
C(���ʯ)+C(ʯī)+Na2CO3(δ��ƽ),���ֺϳɾ�����Զ�����塣����˵������ȷ����
A. �÷�Ӧ�У�������ԭ����������̼��������
B. ÿ����1mol Na2CO3ʱ,��ת��4mol����
C. �÷�Ӧ��Na2CO3����������
D. ��ԭ��Na����C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ�ⷨ���ᴿ����ij�ּصĺ�����������(������ء�̼��ص�)�Ĵ�KOH��Һ���乤��ԭ����ͼ��ʾ��
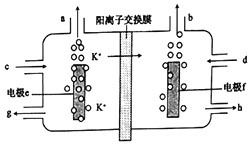
����˵����ȷ���ǣ� ��
A. �缫fΪ�������缫e��H+������ԭ��Ӧ
B. �缫e�ĵ缫��ӦʽΪ4OH--4e-=2H2O+O2��
C. d��������KOH��Һ��g��������KOH��Һ
D. b��ÿ����11.2L���壬����1molK+���������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±������г������� �� ���� �����˱�ǩ������ ��
ѡ�� | A | B | C | D |
���ʵĻ�ѧʽ | HNO3��Ũ�� | �Ҵ� | P4 | CCl4 |
Σ�վ����ǩ |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۺ���ά�ز�����ͬ���칹���ԭ���� ( )
A. ��ɵ�Ԫ�ز�ͬ B. �������ʡ���ѧ���ʲ�ͬ
C. ��ɵĵ��ǵ�Ԫ������ͬ D. ���ӽṹ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�Ļ��������ǻ��������о����ȵ���⡣
��1����̫���ܵ������£���CO2Ϊԭ����ȡ̿�ڵ���������ͼ��ʾ�����ܷ�Ӧ�Ļ�ѧ����ʽΪ_________��

��2��CO2�������⻯�ϳɵ�̼ϩ������ϳ���ϩ�ķ�ӦΪ2CO2��g��+6H2��g��![]() CH2=CH2��g��+4H2O��g����H����֪���ֻ�ѧ���������±���ʾ����CO2�Ľṹʽ��O=C=O��
CH2=CH2��g��+4H2O��g����H����֪���ֻ�ѧ���������±���ʾ����CO2�Ľṹʽ��O=C=O��
���� | H-H | C=O | C=C | C-H | H-O |
����/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
���H=_________��
��3����2L�����ܱ������г���2molCO2��n molH2����һ�������·�����2���еķ�Ӧ��CO2��ת�������¶ȡ�Ͷ�ϱ�[X= ![]() ]�Ĺ�ϵ��ͼ��ʾ��
]�Ĺ�ϵ��ͼ��ʾ��

��X1_________X2�����������������=������ͬ����ƽ�ⳣ��KA_________KB��
����B���Ͷ�ϱ�Ϊ3���Ҵӷ�Ӧ��ʼ��B����Ҫ10min����v��H2��=_______ molL-1��min-1��
��4����ϡ����Ϊ�������Һ������̫���ܽ�CO2ת��Ϊ��̼ϩ��������ԭ��ͼ����ͼ������ϩ�Ľṹ��ʽ��CH3CH=CH2��

��b�缫��������_________��
�ڲ�����ϩ�ĵ缫��ӦʽΪ_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com