
分析 (1)根据溶液中的C(H+),然后根据溶液的pH=-lgC(H+)来计算;
(2)根据Kw=c(H+)•c(OH-)=1×10-14,计算溶液中c(H+),然后根据溶液的pH=-lgC(H+)来计算;
(3)盐酸为一元强酸,硫酸为二元强酸,求出溶液中的C(H+),然后根据溶液的pH=-lgC(H+)来计算;
(4)计算混合后溶液中氢离子的浓度,然后根据溶液的pH=-lgC(H+)来计算;
(5)金属钠溶于水会发生反应得到氢氧化钠溶液,配制成100mL的溶液,计算c(OH-),据Kw=c(H+)•c(OH-)=1×10-14,计算溶液中c(H+),然后根据溶液的pH=-lgC(H+)来计算.
解答 解:(1)c(H+)=1×10-4 mol/L的溶液,pH=-lgC(H+)=-lg(1×10-4 )=4,故答案为:4;
(2)c(OH-)=1×10-4 mol/L的溶液,根据Kw=c(H+)•c(OH-)=1×10-14,溶液中c(H+)=1×10-10 mol/L,所以pH=10,故答案为:10;
(3)将0.1mol HCl溶于水制成100ml溶液,c(H+)=1mol/L的溶液,pH=-lgC(H+)=-lg1=0,故答案为:0;
(4)将PH=2的HCl溶液和PH=2的H2SO4溶液以体积比3:1混和后,c(H+)=$\frac{0.01×3+0.01×1}{4}$mol/L=0.01mol/L,pH=-lgC(H+)=-lg(1×10-2 )=2,故答案为:2;
(5)0.23g即0.01mol金属钠溶于水会发生反应,得到0.01mol氢氧化钠溶液,配制成100mL的溶液,c(OH-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,据Kw=c(H+)•c(OH-)=1×10-14,溶液中c(H+)=10-13mol/L,溶液的pH=-lgC(H+)=13,故答案为:13.
点评 本题考查了溶液的pH的有关计算,题目难度不大,应注意的是pH=-lgC(H+),碱先计算氢氧根离子浓度再根据水的离子积计算氢离子浓度.


科目:高中化学 来源: 题型:解答题
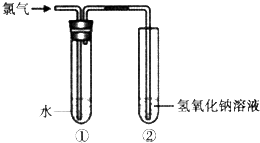 某同学用如图所示装置制取氯水并进行相关实验.
某同学用如图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂或方法 | |
| A | 碘水 | Br2 | 乙醇、萃取 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | 盐酸 |
| D | NaHCO3溶液 | Na2CO3 | 通入过量的CO2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其单体是CH2=CH2和 H-CO-O-CH2CH3 | |
| B. | 它是缩聚反应的产物 | |
| C. | 其链节是 CH3-CH2-CO-O-CH2CH3 | |
| D. | 其单体是 CH2=CH-CO-O-CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合溶液中NO3-的物质的量为0.4 mol | |
| B. | OA段、BC段产生的气体分别是N0、H2 | |
| C. | 第二份溶液中最终溶质为FeS04 | |
| D. | 原混合溶液中H2S04的浓度为5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
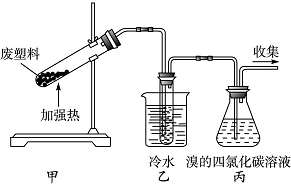 加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯.用如图所示装置探究废旧塑料的再利用.下列叙述中不正确的是( )
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯.用如图所示装置探究废旧塑料的再利用.下列叙述中不正确的是( )| A. | 该实验是聚丙烯的发生加聚反应的实验 | |
| B. | 装置乙的试管中可收集到芳香烃 | |
| C. | 装置丙中的试剂可吸收烯烃以制取卤代烃 | |
| D. | 最后收集的气体可作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯不能使溴水褪色 | B. | 苯能与H2发生加成反应 | ||
| C. | 苯的邻位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ②③④ | B. | ①③⑤⑥ | C. | ②③④⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ•mol-1已知:(a、b、c均大于零),下列说法不正确的是( )
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ•mol-1已知:(a、b、c均大于零),下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com