
我国著名的化学家侯德榜先生(下图)改革国外的纯碱生产工艺,生产流程表示如下:
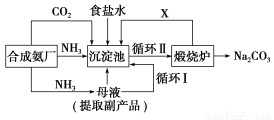

(1)沉淀池中发生的化学反应方程式是
________________________________________________________________________
________________________________________________________________________。
(2)写出上述流程中X物质的分子式________。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________________。
(5)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有________(填编号字母)。
(a)增大NH的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
已知酸性大小:羧酸>碳酸>酚。下列含溴化合物中的溴原子在适当的条件下都能被羟基取代,所得产物能跟NaHCO3溶液反应的是( )
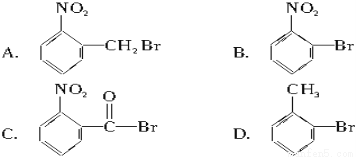
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如右图所示。则下列说法正确的是

A.气态氢化物的稳定性:N>R
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.Y和R形成的化合物既含离子键又含共价键
D.X和M两者最高价氧化物对应的水化物恰好完全反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下课后作业乙烯化学试卷(解析版) 题型:实验题
下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各小题。

(1)碎瓷片的作用是_____________。
(2)B中现象是________,乙烯发生_______反应。
(3)C中现象是________,发生反应的化学方程式______________________。
(4)在D处点燃时必须进行的操作是___________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下课后作业乙烯化学试卷(解析版) 题型:选择题
有关烯烃的下列说法中,正确的是( )
A.烯烃分子中所有的原子一定在同一平面上
B.烯烃在适宜的条件下只能发生加成反应不能发生取代反应
C.分子式是C4H8的烃分子中一定含有碳碳双键
D.烯烃既能使溴水褪色也能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮限时训练四化学试卷(解析版) 题型:选择题
铝碳酸镁[AlaMgb·(CO3)c·(OH)d·eH2O]用于慢性胃炎,称取3.0g铝碳酸镁样品,溶于50mL 2mol/L的盐酸(过量),收集到气体112mL(标准状况);往所得溶液中加入40mL 3mol/L的NaOH溶液,过滤,将所得沉淀洗涤、干燥、称量得固体1.74g;再将滤液稀释到100mL,测得溶液中OH-的浓度为0.1mol/L,由计算可以确定e的值为
A.4 B.5 C.7 D.8
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下期中理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]
已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 |
X | 801 | 2427 | 3660 | 25026 | 32827 |
Y | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
根据上述信息:
①X和氯元素形成的简单分子的空间构型为 。
②Y的基态原子的核外电子排布式为 ,若Y和氯元素形成的分子的相对分子质量为267,请在下列方框中写出该分子的结构式(若存在配位键,用“→”表示)

(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是 ;


解释:②金刚石中的C-C的键长大于C60中C-C的键长的原因是 ;
③金刚石的熔点高于C60的原因是 ;
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.
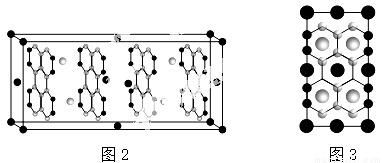
①该化合物的化学式是 ;
②K层与C层之间的作用力是 ;
③K层中K原子之间的最近距离是C-C键的键长dC-C的 倍
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为 cm(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省师大一附高三5月月考理综化学试卷(解析版) 题型:实验题
硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
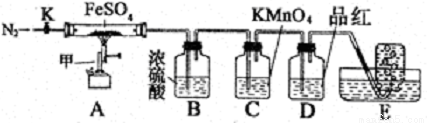
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4) FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
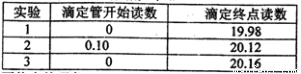
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
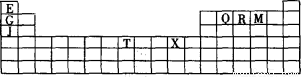
(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X
B.将J2M2溶于水,要破坏离子键和共价键
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大
D.一个Q2E4分子中含有五个δ键和一个π键
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
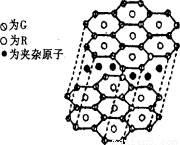
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com