
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B) = 3v(A), 3v(C) = 2v(B)。则此反应可表示为
A.2A + 3B == 2C B.A + 3B == 2C C. 3A + B == 2C D.A + B == C
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.用醋酸除水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2 +2Cl-
D.向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质用途的说法中,正确的是( )
①硅可用来制造半导体材料 ②二氧化硅可用于制造光导纤维
③碳酸氢钠可用于治疗胃酸过多 ④铝合金可用于制造飞机.
|
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
大气污染日益严重,改善大气质量迫在眉睫.
(1)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源.冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂﹣钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的氧化.
①写出CO与NO反应的化学方程式: .
②“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是 .
③控制城市污染源的方法是 (填字母).
a.使用绿色能源 b.带上呼吸面具 c.植树造林
(2)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学取刚降落在热电厂附近的雨水进行实验.
Ⅰ、测得该雨水样品的pH为4.73;
Ⅱ、向雨水样品中滴加BaCl2溶液,有白色沉淀生成;
Ⅲ、每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
①正常雨水的pH为5.6,偏酸性,这是因为 .
②分析上述数据变化,你认为形成这一变化的原因是 .
③兴趣小组同学取某一时段的这种雨水V L,加入0.5mol•L﹣1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00mL Ba(OH)2溶液.请计算:
a.该V L雨水中溶解SO2的体积(标准状况).
b.生成沉淀物的质量范围为 .(列出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行,能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行,能表明反应达到平衡状态的叙述是
A.容器内压强不再变化 B.Fe3O4的物质的量不变
C.v (H2O) = v (H2) D.断裂4 mol H-O键的同时,断裂4 mol H-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能在常温指定环境中大量共存的是
A.在c(H+)=10-10 mol·L-1的溶液中:Al3+ 、NH4+ 、Cl- 、NO3-
B.pH值为1的溶液:Fe2+、Na+ 、SO42-、NO3-
C.水电离出来的c(H+)=10-12 mol·L-1的溶液:K+、HCO3-、Cl-、ClO-
D.pH值为13的溶液:K+ 、CO32-、Na+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。
某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解在250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)上述操作步骤Ⅱ是否正确________(填“是”或“否”);若不正确,请改正_________ _____________________________________________ (若正确,此空不填) 。(2)根据步骤III 填空:
①该实验用的是50ml滴定管,如果液面处的读数是a mL,则滴定管中液体的体积_____(填代号)
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)
④滴定时边滴边摇动锥形瓶,眼睛应观察____________________________________。
⑤滴定达到终点时现象:__________________________________________________。
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的 体积/mL[ | 标准溶液的 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2]=3∶1时,溶液中无HCO3-
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2]=1∶1时,能得到澄清溶液
C.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42- BaSO4↓+2H2O
BaSO4↓+2H2O
D.向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3- CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是 ( )
A.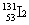 和
和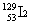 互为同位素
互为同位素
B.NH5的电子式为: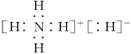
C.氯原子的结构示意图:
D.中子数为146、质子数为92的铀(U)原子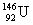
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com