
实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。
某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解在250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)上述操作步骤Ⅱ是否正确________(填“是”或“否”);若不正确,请改正_________ _____________________________________________ (若正确,此空不填) 。(2)根据步骤III 填空:
①该实验用的是50ml滴定管,如果液面处的读数是a mL,则滴定管中液体的体积_____(填代号)
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)
④滴定时边滴边摇动锥形瓶,眼睛应观察____________________________________。
⑤滴定达到终点时现象:__________________________________________________。
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的 体积/mL[ | 标准溶液的 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为________。
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
用如图装置制取、干燥并收集选项中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的( )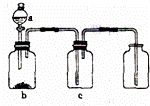
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | Cu | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物①NaHCO3,②Al(OH)3,③AlCl3,④H2N﹣CH2﹣COOH,⑤Na2CO3跟盐酸和氢氧化钠溶液都能反应的是( )
|
| A. | ②③④ | B. | ①②④ | C. | ①②③ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B) = 3v(A), 3v(C) = 2v(B)。则此反应可表示为
A.2A + 3B == 2C B.A + 3B == 2C C. 3A + B == 2C D.A + B == C
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.用 水稀释0.1 mol·L-1的氨水,则溶液中c(NH3·H2O)/ c(OH-)增大
水稀释0.1 mol·L-1的氨水,则溶液中c(NH3·H2O)/ c(OH-)增大
B.pH=3的盐酸和醋酸分别升高相同的温度,pH均不变
C.在等体积等pH 的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸;
D.两种氨水溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c2=10 c1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg C12含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数个粒子的物质的量是1 mol
D.1 mol NH3所含原子数约是2.408×1024
查看答案和解析>>
科目:高中化学 来源: 题型:
运动会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为:5KClO3+6P===3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中Cl的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应被还原与被氧化物质的物质的量之比为5∶6
D.上述反应中消耗3 mol P时,转移电子的物质的量为15 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
(1)稀盐酸物质的量浓度为___________。
(2)Na2CO3·xH2O的摩尔质量为___________。
(3)x=_______。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出电子转移的方向和数目。
(2)反应产物中,氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
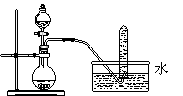
下列实验设计或实验操作中,正确的是 ( )
 | |||
 |
A.铜与浓硝酸反应制取NO2 B.该装置设计合理,可实现石油的分馏
 |
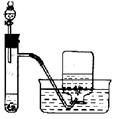
C.称量25g氢氧化钠 D.H2O2溶液与MnO2制备O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com