
| ||
| 54g |
| 108g/mol |
| 0.5mol |
| 4 |
| ||


科目:高中化学 来源: 题型:
 硝酸是一种重要的化工原料,工业上生成硝酸的主要方法如下:
硝酸是一种重要的化工原料,工业上生成硝酸的主要方法如下:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图象 |  |  |  |  |
| 11 |
| 12 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
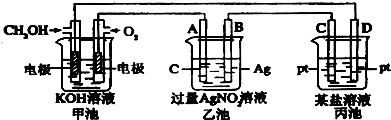
 某课外活动小组用右图进行实验,试回答下列问题.
某课外活动小组用右图进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若存在简单阴离子R-,则R一定属于ⅦA族 |
| B、若存在简单阴离子R2-,则R一定属于VIA族 |
| C、若存在简单阳离子M+,则M一定属于IA族 |
| D、若存在简单阳离子M2+,则M一定属于ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④⑤ |
| C、①②④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )| A、在正极发生的电极反应为:AgO+2e-+H2O=Ag+2OH- |
| B、在正极区H+浓度增大,在负极区H+浓度减少 |
| C、该电池总反应的化学方程式:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O |
| D、当电池负极的质量变化10.8g,则过程中电池流动的电子物质的量为1.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com