
【题目】化学实验操作要遵循安全性和简约性,如图操作正确但不是从安全性方面考虑的操作是
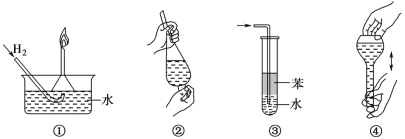
A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C.操作③:吸收氨气或氯化氢气体并防止倒吸
D.操作④:配制一定物质的量浓度溶液时的“摇匀”操作
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化硫是大气的主要污染物之一。催化还原SO2不仅可以消除SO2的污染,还可以得到工业原料S。燃煤烟气中硫的回收反应为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △H。
2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
则硫的回收反应的△H=___________ kJ·mol-1。
(2)其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图所示。260℃时,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________。

(3)一定条件下,若在恒压密闭容器中发生硫的回收反应,SO2的平衡转化率与温度、压强的关系如图所示,则P1、P2、P3、P4由大到小的顺序为___________;某温度下,若在恒容密闭容器中,初始时c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡转化率为80%,则该温度下反应的化学平衡常数为___________。
(4)某实验小组为探究烟气流速、温度对该反应的影响,用La2O3作催化剂,分别在两种不同烟气流量、不同温度下进行实验。实验结果显示:在260℃时,SO2的转化率随烟气流量增大而减小,其原因是___________;在380℃时,SO2的转化率随烟气流量增大而增大,其原因是___________。
(5)工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0 mol·L-1的N2SO3溶液,当溶液pH约为6时,吸收SO2的能力显著下降此时溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CH4燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为49.6 g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2 g,则混合气中CO的质量为( )。
A. 24.4 gB. 13.2 gC. 12.5 gD. 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲探究含硫物质的性质及制备。
(探究一)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
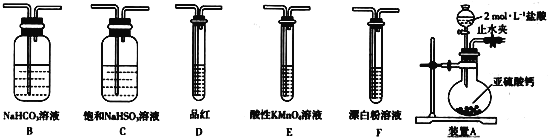
(1)装置A中盛固体的玻璃仪器名称是____,装置A中反应的离子化学方程式为_________。
(2)装置连接顺序为A__________,其中装置C的作用是_________,通过现象_______,即可证明亚硫酸的酸性强于次氯酸。
(探究二)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
(3)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100mL容量瓶中,再定容至凹液面与刻度线相平。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72+6I+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32=S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当______即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
(4)Na2S2O3常用于脱氯剂,在溶液中易被氯气氧化为SO42-,该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。根据如图回答下列问题:

(1)写出D的结构简式:____________________________。
(2)写出②⑤两步反应的化学方程式,并注明反应类型:
②__________________________________________________(反应类型____________)。
⑤__________________________________________________(反应类型____________)。
(3)利用反应①制备的B中常常还含有少量的A,在实验室中如何除去B中含有的少量杂质A:_________________________________________________(答试剂及操作方法)。
(4)某科研工作者以A为原料成功合成一种分子式为C6H14的物质F,物质F的可能结构有_________种,物质F与B的关系为___________________(选填A、B、C、D)。
A.同一种物质B.互为同分构体C.互为同系物D.互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是( )
A.用Fe、Cu和稀硫酸组成原电池,当负极质量减轻5.6g时,通过溶液的电子为0.2NA
B.标准状况下,2.24L三氯甲烷中含氢原子数为0.1NA
C.密闭容器中,2molSO2和1molO2充分反应后分子总数为2NA
D.11.6g丁烷中所含的非极性键数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生用如图装置研究原电池原理,下列说法错误的是( )
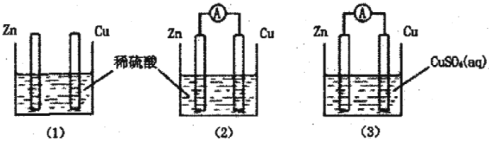
A.(2)图中电子由Zn沿导线流向Cu
B.(3)图中Zn片增重质量与Cu棒减轻质量比值为65∶64
C.(1)图中铜棒上没有气体产生
D.(2)图与(3)图中正极生成物质量比为1∶32时,Zn片减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
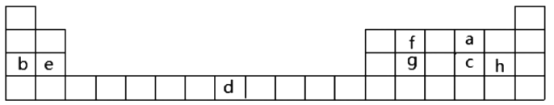
(1)表中字母h元素在周期表中位置___。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型___。
(3)下列事实能说明a元素的非金属性比c元素的非金属性强的有___。
A.a单质与c的氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mola单质比1molc单质得电子数目多
C.a和c两元素的简单氢化物受热分解,前者的分解温度高
(4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式___。
(5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学方程式___。
(6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,该烃分子中碳氢质量比为9∶1,写出烃分子电子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com