
【题目】用下图装置可以完成一系列实验(图中夹持装置及加热装置已略去),不考虑①②③中物质间的相互影响。请回答下列问题:
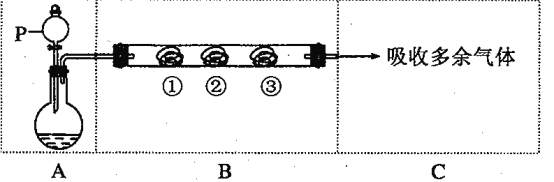
(1)若装置A选用浓盐酸和二氧化锰混合制取Cl2气体,装置B中的三处棉花依次做了如下处理。请填写表中空白:
B中棉花的位置 | ① | ② | ③ |
所蘸试剂 | 石蕊溶液 | 淀粉KI溶液 | 浓氨水 |
现象 | ________ | ________ | ________ |
涉及的化学方程式 | ________ | ________ | 3Cl2+8NH3=6NH4Cl+N2 |
(2)若装置A选用浓硫酸和亚硫酸钠固体制取SO2气体,装置B中的三处棉花依次做了如下处理。请填写表中空白:
B中棉花的位置 | ① | ② | ③ |
所蘸试剂 | H2S溶液 | 酸性KMnO4溶液 | 品红溶液 |
现象 | ________ | ________ | 褪色 |
体现SO2的性质 | ________ | ________ | ________ |
【答案】先变红后褪色 变蓝 产生白烟 Cl2+H2OHCl+HClO Cl2+2KI=2KCl+I2 黄色物质产生 褪色 氧化性 还原性 漂白性
【解析】
根据氯气和二氧化硫的性质,结合图示分析实验中发生的化学反应及实验现象。
(1)因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,涉及的反应为:Cl2+H2OHCl+HClO;氯气与碘化钾溶液反应:Cl2+2KI=2KCl+I2,碘单质使淀粉变蓝;氯气与浓氨水挥发出的氨气反应生成氯化铵晶体,所以看到白烟,
故答案为:先变红后褪色;变蓝;产生白烟;Cl2+H2OHCl+HClO;Cl2+2KI=2KCl+I2;
(2)二氧化硫与硫化氢反应生成硫单质和水,二氧化硫中的硫元素化合价降低,体现氧化性,现象是有黄色物质产生;高锰酸钾有强氧化性,可以被二氧化硫还原,体现二氧化硫的还原性,现象是褪色;二氧化硫可以使品红褪色,体现二氧化硫的漂白性,
故答案为:黄色物质产生;褪色;氧化性;还原性;漂白性。


科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是:
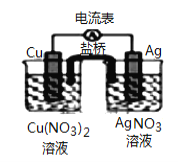
A. 原电池的总反应式为:Cu+2AgNO3 = 2Ag+Cu(NO3)2
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 在外电路中,电子由银电极流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积为2L的密闭容器中(容积不变)通人3mo1和1molB,发生反应3A(g)+B(g)xC(g);经过2min的时间该反应达到平衡状态(假设温度不变),剩余的B的物质的量为0.8mol并测得C的浓度为0.4 molL-1
请回答下列问题:
(1)整个反应过程中,B的平均反应速率为______________
(2)x=_______,平衡常数K=_______.
(3)如果向该平衡体系中通人少量氮气、增大反应体系的压强,那么化学平衡的移动方向是____________.
(4)若温度不变,再向原平衡混合物的容器中充人amolC在t℃时达到新的平衡,此时B的物质的量为nmol,则C的物质的量为_____(用含n的表达式表示),平衡常数K______(填“增大”“减小”或不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KC1O3和草酸(H2C2O4)在60℃时反应制得。某学生用下图所示的装置模拟工业制取及收集C1O2,其中A为C1O2的发生装置,B为C1O2的凝集装置,C为尾气吸收装置。
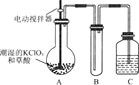
请回答下列问题:
(1)A中反应产物有K2CO3、C1O2和CO2等,请写出该反应的化学方程式:________________________。
A部分还应添加温水浴控制温度在60 °C,B部分还应补充什么装置:_________________。
(2)该装置按(1)补充完整后,装置A、B、C中还有一处设计明显不合理的是_____(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为____________。若实验时需要450 mL 4 mol L-1的NaOH溶液,则在精确配制时,需要称取NaOH的质量是____g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3![]() H++HCO3-……① HCO3-
H++HCO3-……① HCO3-![]() H++CO32-……②
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
A.加热、平衡①、②可能都向左移动
B.加入澄清石灰水,平衡①、②均向右移动
C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动
D.通入过量CO2或滴加氯水,溶液pH均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
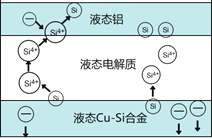
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下述为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O ![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s) + O2 (g)=Cu2O(s) △H1= akJ/mol
②C(s)+ ![]()
![]() O2 (g)=CO(g) △H2= bkJ/mol
O2 (g)=CO(g) △H2= bkJ/mol
③Cu(s)+ ![]()
![]() O2 (g)= CuO(s) △H3= ckJ/mol
O2 (g)= CuO(s) △H3= ckJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O装置如图所示:

①如图装置中D电极应连______电极。(填“A”或“B”)
②该离子交换膜为______离子交换膜(填“阴”或“阳”),该电解池的B极反应式为:____________________________________________。
③C极反应式为:____________________________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O![]() 2H2(g)+O2(g)△H>0,水蒸气的浓度随时间t变化如表所示:
2H2(g)+O2(g)△H>0,水蒸气的浓度随时间t变化如表所示:

根据上述数据分析:
①催化剂的效率:实验①_______实验②(填“>”或“<”);
②通过实验①、③分析,T1______T2(填“>”或“<”);
③实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com