
【题目】汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3![]() H++HCO3-……① HCO3-
H++HCO3-……① HCO3-![]() H++CO32-……②
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
A.加热、平衡①、②可能都向左移动
B.加入澄清石灰水,平衡①、②均向右移动
C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动
D.通入过量CO2或滴加氯水,溶液pH均减小
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
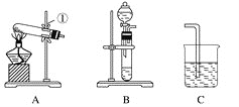
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
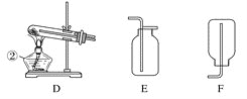
【题目】“84消毒液”与硫酸溶液反应可以制取氯气,反应原理为:NaClO + NaCl + H2SO4 ![]() Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
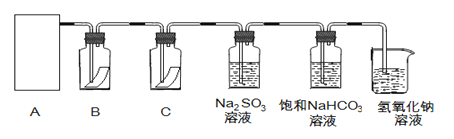
(1)从①、②、③装置中选择合适的制氯气装置(A处)___________ (填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________;说明该装置存在明显的缺陷,请提出合理的改进的方法 _______________________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-。写出氯气与Na2SO3溶液反应的离子方程式 ________________,检验反应后溶液中含有SO42-的方法:取少量反应后溶液于试管中,先加入足量的_____至无明显现象,然后再加入少量____溶液有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 ________________ (填“盐酸”或“次氯酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为_______,用化学式表示一种由B、C、E组成的物质_____。
(2)B的氢化物比E的氢化物的沸点____ (填“高”或“低”),理由是__________。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
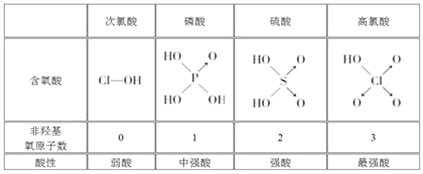
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸______________________,亚砷酸________________________。
(2)亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式分别是:
亚磷酸:______________________________________,
亚砷酸:_______________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
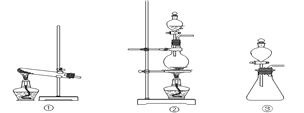
【题目】用下图装置可以完成一系列实验(图中夹持装置及加热装置已略去),不考虑①②③中物质间的相互影响。请回答下列问题:
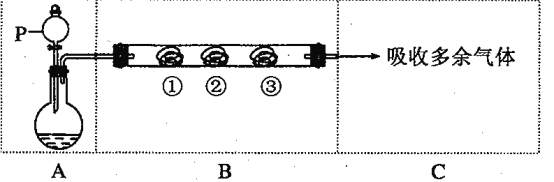
(1)若装置A选用浓盐酸和二氧化锰混合制取Cl2气体,装置B中的三处棉花依次做了如下处理。请填写表中空白:
B中棉花的位置 | ① | ② | ③ |
所蘸试剂 | 石蕊溶液 | 淀粉KI溶液 | 浓氨水 |
现象 | ________ | ________ | ________ |
涉及的化学方程式 | ________ | ________ | 3Cl2+8NH3=6NH4Cl+N2 |
(2)若装置A选用浓硫酸和亚硫酸钠固体制取SO2气体,装置B中的三处棉花依次做了如下处理。请填写表中空白:
B中棉花的位置 | ① | ② | ③ |
所蘸试剂 | H2S溶液 | 酸性KMnO4溶液 | 品红溶液 |
现象 | ________ | ________ | 褪色 |
体现SO2的性质 | ________ | ________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
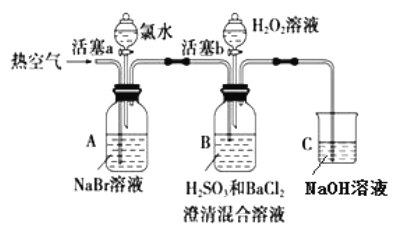
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以完成的实验组合是
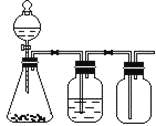
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
【答案】B
【解析】
A. 二氧化锰与氯酸钾制取氧气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项A错误;
B.大理石与盐酸生成二氧化碳气体,属于固液常温型,盐酸有挥发性,挥发的HCl能与碳酸氢钠溶液反应产生二氧化碳气体,且二氧化碳密度比空气的大,能用向上排空气法收集;选项B正确。
C.锌粒与稀硫酸反应生成氢气,属于固液常温型,但氢气密度比空气的小,不能用向下排空气法收集,选项C错误;
D. 二氧化锰与浓盐酸制取氯气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项D错误;
故合理选项是B。
【题型】单选题
【结束】
20
【题目】下列物质中,不可作漂白剂的是( )
A. SO2 B. Ca(ClO)2 C. Na2SiO3 D. NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在 KClO3 晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )
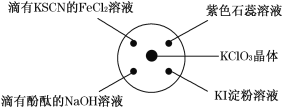
选项 | 实验现象 | 结论 |
A | 滴有 KSCN 的 FeCl2 溶液变红色 | Cl2 具有还原性 |
B | 滴有酚酞的 NaOH 溶液褪色 | Cl2 具有酸性 |
C | 淀粉 KI 溶液中变蓝色 | Cl2 具有氧化性 |
D | 石蕊溶液先变为红色后褪色 | Cl2 具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com