
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。
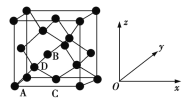
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。
【答案】3d104s24p2 2 Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强 O>Ge>Zn sp3 共价键 (![]() ,
,![]() ,
,![]() )
) ![]() ×107
×107
【解析】
试题(1)Ge是32号元素,与碳元素是同一主族的元素,在元素周期表中位于第四周期IVA族;基态Ge原子的核外电子排布式为[Ar] 4s24p2,也可写为3d104s24p2;在其原子的最外层的2个4s电子是成对电子,位于4s轨道,2个4p电子分别位于2个不同的4p轨道上,所以基态Ge原子有2个未成对的电子;(2)Ge与C是同族元素,C原子原子半径较小,原子之间可以形成双键、三键;但Ge原子之间难以形成双键或三键,从原子结构角度分析,这是由于锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成π键;(3)锗元素的卤化物在固态时都为分子晶体,分子之间通过微弱的分子间作用力结合。对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越大,熔沸点越高。由于相对分子质量:GeCl4<GeBr4<GeI4,所以它们的熔沸点由低到高的顺序是:GeCl4<GeBr4<GeI4;(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。元素的非金属性越强,其吸引电子的能力就越强,元素的电负性就越大。元素Zn、Ge、O的非金属性强弱顺序是:O>Ge>Zn,所以这三种元素的电负性由大至小的顺序是O>Ge>Zn ;(5) Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为1个s轨道与3个p轨道进行的sp3杂化;由于是同一元素的原子通过共用电子对结合,所以微粒之间存在的作用力是非极性共价键(或写为共价键);(6) ①根据各个原子的相对位置可知,D在各个方向的1/4处,所以其坐标是(![]() ,
,![]() ,
,![]() );根据晶胞结构可知,在晶胞中含有的Ge原子数是8×1/8+6×1/2+4=8,所以晶胞的密度
);根据晶胞结构可知,在晶胞中含有的Ge原子数是8×1/8+6×1/2+4=8,所以晶胞的密度![]() =
=![]() cm3。
cm3。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】已知二氧化硅,二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性.
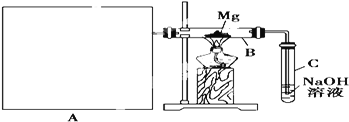
Ⅰ![]() 用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂_____________________________![]() 填序号
填序号![]() 。
。
①![]() 的硫酸溶液②
的硫酸溶液②![]() 硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
(2)写出装置B中发生置换反应的化学方程式:_____________________________装置C中氢氧化钠溶液的作用是_____________________________
(3)请在图中画出制备二氧化硫的发生装置,注明仪器名称,固定仪器省略不画。_______________
(4)你认为该装置的不足之处____________________________________________________![]() 任写2条
任写2条![]()
Ⅱ![]() 某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
他们在实验报告中记录着:“![]() 选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量
选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量![]() 在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的
在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的![]() 左右.”
左右.”
(5)该小组“实验室制硅”的化学方程式是_____________________________
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花:的原因是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒、烧杯外,还需要的玻璃仪器有__________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是__________。判断滴定终点的现象是_____
(3)实验2,滴定前液面在“0”刻度处,滴定后液面如图所示,其读数为________mL。根据上述数据,可计算出该盐酸的浓度为__________。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有(_______)
A. 配制标准溶液定容时,仰视刻度线
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
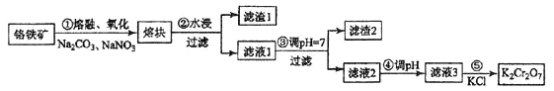
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;

(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___(填试剂名称)。
②用 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。

①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________(填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___;写出其中CO与NO完全转化为无害气体的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
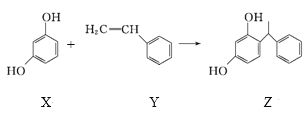
下列叙述错误的是( )
A.X、Y和Z均能使溴水褪色
B.X和Z均能与NaHCO3溶液反应放出CO2
C.Y既能发生取代反应,也能发生加成反应
D.Y可作加聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
下列说法中正确的是
A. 在条件I下,该反应的平衡常数K=10
B. 在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C. 在条件II下,到达平衡时, I2(g)的转化率为81.25%
D. 与条件I相比,为达到条件II的数据,可能改变的条件是降低压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com