
【题目】科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。

①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
【答案】 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol 低温 C2H4-12e-+6CO32-=8CO2+2H2O > D c(Na+)>c(CO32-)>c(HCO3-)>c(H+) 14%或0.14 逆向 减小
C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol 低温 C2H4-12e-+6CO32-=8CO2+2H2O > D c(Na+)>c(CO32-)>c(HCO3-)>c(H+) 14%或0.14 逆向 减小
【解析】(1).根据题给信息分别写出三个热化学反应方程式:H2O(g)=H2O(l)ΔH=-44.0kJ/mol,C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=-1411.0kJ·mol- ,H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol;根据盖斯定律,整理出热化学方程式并计算出反应的ΔH;正确答案:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;该反应为一个S<0,ΔH<0的反应,在低温下能够进行;正确答案:低温;
C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;该反应为一个S<0,ΔH<0的反应,在低温下能够进行;正确答案:低温;
(2)乙烯气体与氧气形成的燃料电池,电解质为熔融碳酸钠;乙烯做负极被氧化生成二氧化碳;根据电子守恒和电荷守恒规律,极反应为: C2H4-12e-+6CO32-=8CO2+2H2O;正确答案:C2H4-12e-+6CO32-=8CO2+2H2O;
(3从图像看出,温度升高,二氧化碳的转化率降低,该反应正反应为放热反应;升高温度,平衡左移,平衡常数减小;
①正确答案:KM >KN;
② 可逆反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;其他条件下不变,反应前后的气体的总质量不变,容器的体积不变,混合气体密度恒为定值,无法判定平衡状态,A错误;该反应为反应前后气体总量减少的反应,压强不变可以判定反应达平衡状态,但是氢气、二氧化碳均为反应物,按一定比例关系进行反应,n(H2)/n(CO2)始终保持不变,无法判定平衡状态, B错误;温度高于250℃时,催化剂的催化效率降低,但是催化剂对平衡的移动无影响,向左移动是因为温度升高的缘故;C错误;该反应为气体体积减少的的反应,若将容器由“恒容”换为“恒压”,其他条件不变,相当于加压的过程,平衡右移,CO2的平衡转化率增大,D正确;正确答案:D;
C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;其他条件下不变,反应前后的气体的总质量不变,容器的体积不变,混合气体密度恒为定值,无法判定平衡状态,A错误;该反应为反应前后气体总量减少的反应,压强不变可以判定反应达平衡状态,但是氢气、二氧化碳均为反应物,按一定比例关系进行反应,n(H2)/n(CO2)始终保持不变,无法判定平衡状态, B错误;温度高于250℃时,催化剂的催化效率降低,但是催化剂对平衡的移动无影响,向左移动是因为温度升高的缘故;C错误;该反应为气体体积减少的的反应,若将容器由“恒容”换为“恒压”,其他条件不变,相当于加压的过程,平衡右移,CO2的平衡转化率增大,D正确;正确答案:D;
③250℃时,根据图像看出,二氧化碳的转化率为50%,平衡后剩余二氧化碳的量1×50%=0.5mol,设反应生成碳酸氢钠xmol,碳酸钠y mol,根据碳原子守恒:x+y=0.5;根据钠离子守恒:x+2y=3×0.3,解之,x= 0.1mol ,y=0.4mol;即碳酸氢钠0.1mol,碳酸钠 0.4mol, 碳酸钠的量比碳酸氢钠大,CO32-水解很少,剩余得多;所以c(CO32-)>c(HCO3-);溶液中离子浓度大小关系:c(Na+)>c(CO32-)>c(HCO3-)>c(H+);正确答案:c(Na+)>c(CO32-)>c(HCO3-)>c(H+);
④可逆反应: 2CO2(g)+6H2(g)![]() C2H4(g) + 4H2O(g)
C2H4(g) + 4H2O(g)
起始量:1 3 0 0
变化量 1×50% 3×50% 0.5×50% 2×50%
平衡量 0.5 1.5 0.25 1
混合气体的总质量:1×44+3×2=50g, 乙烯的质量:0.25×28=7 g,所以乙烯的质量分数为7÷50×100%= 14%或0.14;正确答案:14%或0.14;
(5)增大体积,相当于减压,平衡向左移动;正确答案:逆向;反应前后混合气体的总质量不变,体积变大,所以密度减少;正确答案:减小;


科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
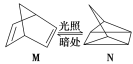 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸
④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④①②⑤③B.①②④⑤③C.①④②⑤①③D.①②⑤④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列三种气态物质之间的反应:
C2H2(g)+H2(g)![]() C2H4(g)①
C2H4(g)①
2CH4(g)![]() C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g) ΔH=-Q1kJ/mol
C(s)+![]() H2(g)=
H2(g)=![]() C2H2(g) ΔH=-Q2kJ/mol
C2H2(g) ΔH=-Q2kJ/mol
C(s)+H2(g)=![]() C2H4(g) ΔH=-Q3kJ/mol
C2H4(g) ΔH=-Q3kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。
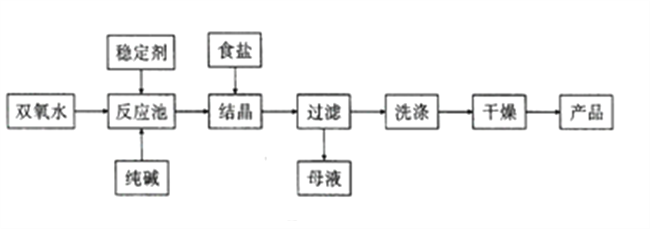
(1)碳酸钠水溶液呈碱性的原因是____________(用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____(填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________,母液中可循环使用的物质是_________(填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量![]() 来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有许多的 “守恒或相等”,下列说法中不满足守恒或相等的是
A. 化学反应中,参加反应物总质量与生成物总质量
B. 化学反应中,反应物总能量与生成物总能量
C. 溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数
D. 溶液中,稀释前溶质质量与稀释后溶质质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. NO2通入水中:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于1mol/L K2SO4溶液的下列说法正确的是( )
A.溶液中含有1mol K2SO4
B.1molK2SO4溶于1L水中
C.溶液中c(K+ )=2mol/L
D.1L 溶液中含2molK+ , 4mol O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物柴油是一种用植物油、动物油或废弃油脂等为原料加工而成的清洁燃料,主要成分为高级脂肪酸甲酯。一种用菜籽油等为原料制备生物柴油的实验步骤如下:
①向右图所示的三口烧瓶中加入3.2 g CH3OH、0.2 g NaOH,溶解后向其中加入20 g(0.021~0.023 mol)菜籽油及60 mL正己烷。


②加热至60~65 ℃,搅拌2.5~3 h,静置。上层为生物柴油、正己烷及甲醇,下层主要为甘油。
③分液、水洗。
④蒸馏,保持120℃时至无液体流出,剩余物为生物柴油。
(1)步骤①中控制n(CH3OH)/n(油脂)>3的目的是________;正己烷的作用是________。
(2)步骤②适宜的加热方式是________;菜籽油的成分之一油酸甘油酯(结构简式如右图)与甲醇反应的化学方程式为________________________________________________。
(3)步骤③用分液漏斗分离时,获取上层液体的方法是________;用水洗涤上层液体时,说明已洗涤干净的依据是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com