
如图是传统的工业生产金属铝的基本流程图: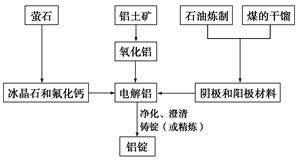
结合流程图回答下列问题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。煤的干馏产物__________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050℃,工业上为了降低能量消耗,在金属铝的冶炼过程中采取的措施是________________________________________________________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是__________________________________________________________。
(4)工业上制取金属镁采取电解熔融MgCl2的方法,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?________________________________________________________________________。
科目:高中化学 来源: 题型:填空题
A、B、C、D是中学化学中常见的单质, D为地壳中含量最多的金属;甲、乙、丙为化合物,其中甲为有磁性的黑色晶体,乙在常温常压下为无色液体。各物质的转化关系如下: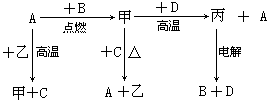
(1)组成D的元素在周期表中的位置是 。
(2)若用一种反应类型概括上述转化中所涉及到的全部反应,该反应类型是 。
(3)在上述电解反应中,阳极的电极反应式是 。
(4)甲和D反应的化学方程式是 。
(5)D的某种盐常用于净水,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关FeSO4的转化关系如下图所示(无关物质已略去)。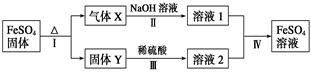
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: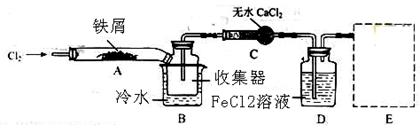
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④........
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下: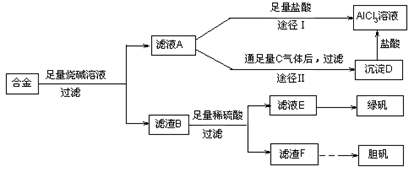
请回答下列问题:
(1)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是:
。
(2)从滤液E中得到绿矾晶体的实验操作是 。
(3)请用一个总反应式表示由滤渣F制备胆矾晶体过程中发生的变化:
。
(4)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: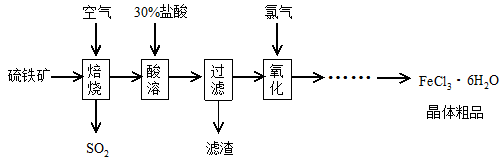
回答下列问题:
(1)焙烧硫铁矿的主要方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在: 。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作崔化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚铁铵【(NH4)2Fe(SO4)2】俗称莫尔盐,工业上用途广泛,该物质属于 。
A、酸 B、碱 C、盐
某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作。
(1)室温下,将少量的硫酸亚铁铵晶体配成溶液,并将所配溶液分置于两支试管中,用其中一支进行验证Fe2+的实验,请完成下表:
| 操作 | ①往试管中滴入几滴 溶液(填化学式) | ②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业制备氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去? ,(填“能” 或“不能”)理由是 ,
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,(填“是” 或“否”)现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com