
【题目】下列各项表述得不够科学严密的是( )
A.有电子转移(得失或偏移)的化学反应都是氧化还原反应
B.p电子原子轨道的平均半径随电子层的增大而增大
C.电子是在原子核外,能量由低到高的不同电子层上分层排布的
D.氢原子电子云图中小黑点表示电子的运动轨迹
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目: 。
(4)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)△H<0,在一定条件下达到平衡,测得c(SO3)=0.040mol/L.
(1)该条件下反应的平衡常数K的数值为 , 如升高温度,则K值(填“增大”、“减小”或“不变”).
(2)在其他条件不变时
①若增大O2的浓度,则SO2的转化率(填“增大”或“减小”);
②若升高温度,则平衡(填字母代号);
A.不移动 B.向正反应方向移动 C.向逆反应方向移动
③欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 . (填字母代号)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.使用催化剂V2O5 D.降低反应的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验或装置的叙述中,正确的是( ) 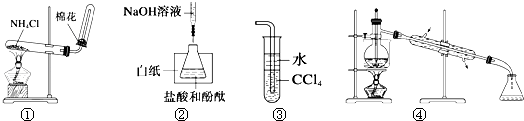
A.实验①可用于制取氨气
B.实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点
C.装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸
D.装置④可用于从酒精水溶液中制取无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是:
A.H2O B.H2SO4 C.NaH D.NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
(已知Ksp[Fe(OH)3]=3.8×10﹣38; Ksp[Cu(OH)2]=2×10﹣20;Ksp(ZnS)=1.6×10﹣24)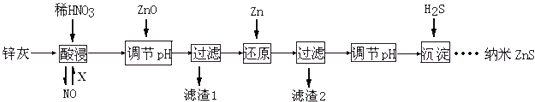
下列说法不正确的是( )
A.酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO3﹣=3Fe3++NO↑+5H2O
B.将酸浸的尾气循环利用,加入的X气体可以是O2
C.滤渣2中的成分和Zn和Fe
D.当溶液中Zn2+浓度为小于1.0×10﹣5molL﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.6×10﹣19molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列晶体性质的比较中正确的是( )
A.沸点:NH3>H2O>HF
B.熔点:金刚石>碳化硅>晶体硅
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4<SiBr4<SiCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某NaOH溶液中取任意体积的溶液时,下列物理量一定没有发生变化的是( )
A. 溶液中NaOH的物质的量 B. 溶液中Na+的物质的量浓度
C. 溶液中Na+的数目 D. 溶液的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com