
����Ŀ���ơ�þ�����ĵ��ʼ��仯��������ѧ���ص���峵����.
(1)�����ʷ��࣬Na2O2____________(����������������������)���������
(2)�����ӷ���ʽ˵��Al(OH)3������������� ____________________��
(3)ijͬѧ����ͼ��ʾװ�ý���ʵ��̽���й��ơ�þ�����Ļ����������(�г�����ʡ��)����Һ��A�������뵽����B�У��ش��������⣺
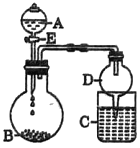
����AΪ70%������Һ��BΪNa2SO3��Cʢ��������(H2S)������Һ������E��C�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
����AΪˮ��BΪMg3N2��C��ʢ��AlC13��Һ������E���㹻����ʱ���C�з�����Ӧ�����ӷ���ʽΪ__________________________��
����AΪŨ���ᣬBΪNaClO3��C��ʢ��KI-������Һ������E��C�е�������________________������ͨ������C�У��㹻����ʱ�����C����Һ����ɫ��ʧ��������Ϊ����Һ��I2�ܱ�Cl2����ΪHIO3��д���÷�Ӧ�Ļ�ѧ����ʽ�� _______________��
���𰸡������� Al(OH)3+OH-=AlO2-+2H2O��Al(OH)3+3H+=Al3++3H2O 2H2S+SO2=3S��+2H2O Al3++3NH3��H2O=Al(OH)3��+3NH4+ ��Һ����ɫ�����ɫ 6H2O+I2+5Cl2=2HIO3+10HCl
��������
(1)���ݹ���������ˮ��Ӧ��������жϣ�
(2)�ܹ���Ӧ�����κ�ˮ��Ҳ�����ᷴӦ�����κ�ˮ�������������
(3)��������Na2SO3������Ӧ����SO2��SO2��H2S����Һ�з�����Ӧ����S���ʺ�ˮ�����ݵ����غ㡢ԭ���غ���д����ʽ��
��Mg3N2��ˮ������Ӧ����������þ�Ͱ�������������Һ����AlC13��Ӧ�������������������Ȼ�泥�
��Ũ������NaClO3����������ԭ��Ӧ����Cl2��������KI����ΪI2��I2��������Һ��Ϊ��ɫ�������������������������ὫI2����ΪHIO3��C����Һ����ɫ������������ԭ��Ӧ������д��Ӧ����ʽ��
(1)�������������������ᷴӦ�����κ�ˮ��������,����������ˮ��Ӧ����NaOH��O2����Ӧ����������⣬�����������ɣ���˹������Ʋ��Ǽ��������
(2)Al(OH)3�ǽ�����������ܹ���Ӧ�����κ�ˮ��˵�������������ʣ�Al(OH)3��ǿ��NaOH��Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-=AlO2-+2H2O����ǿ��HCl��Ӧ�����Ȼ�����ˮ��˵������м�����ʣ��÷�Ӧ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O��
(3)��������Na2SO3������Ӧ����SO2����Ӧ����ʽΪH2SO4+Na2SO3=Na2SO4+SO2��+H2O��SO2��H2S����Һ�з�����Ӧ����������ˮ�ĵ���S��ˮ���÷�Ӧ�����ӷ���ʽΪ��2H2S+SO2=3S��+2H2O��
��Mg3N2��ˮ������Ӧ����������þ�Ͱ�������������ˮ�õ�һˮ�ϰ�������Һ��һˮ�ϰ���AlC13��Ӧ�������������������Ȼ�泥����C�з�����Ӧ�����ӷ���ʽΪAl3++3NH3��H2O=Al(OH)3��+3NH4+��
��Ũ������NaClO3����������ԭ��Ӧ����Cl2����Ӧ����ʽΪ6HCl(Ũ)+ NaClO3=NaCl+3Cl2��+3H2O����Ӧ��������������Һ��KI����ΪI2��I2��������Һ��Ϊ��ɫ����˿���C����Һ��Ϊ��ɫ������ͨ������C�У��㹻����ʱ����������������������������ὫI2����ΪHIO3����Һ����I2������ֿ���C����Һ����ɫ������������ԭ��Ӧ�е��ӵ�ʧ��Ŀ��ȣ��ɵø÷�Ӧ�Ļ�ѧ����ʽΪ��6H2O+I2+5Cl2=2HIO3+10HCl��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ2NO2N2O4(g) H<0����һ������NO2����ע�����в��ܷ⣬�ı����λ�õĹ����У�����������ʱ��ı仯��ͼ��ʾ(������ɫԽ�����ԽС)������˵������ȷ����
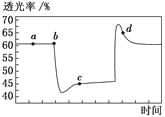
A.b ��IJ�����ѹ��ע����
B.c ����a����ȣ�c(NO2)����c(N2O4)��С
C.d �㣺��(��)<��(��)
D.����c�㽫�¶Ƚ��ͣ������ʽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���� ( )
A. ��ϡHNO3�еμ�Na2SO3��Һ��SO32-+2H+=SO2��+H2O
B. ����SO2ͨ������������Һ�У�OH-+SO2=HSO3-
C. ���ȿ���ǿ������Һȥ��������CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. �ö��Ե缫���CuSO4��Һ��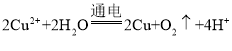
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;,����(Ni)�������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ������˵���������ǣ� ��
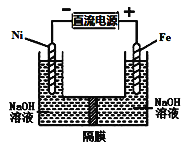
A�����缫�ϵĵ缫��ӦΪ2H2O+2e-![]() H2��+2OH-
H2��+2OH-
B����������, �缫��ӦΪFe-2e-+OH-![]() Fe(OH)2
Fe(OH)2
C������ĤΪ�����ӽ���Ĥ, ��OH-���������ƶ�
D�����ʱ������pH���͡�������pH����, ������ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���Ӧ��6H2(g)+2CO2(g)![]() C2H5OH(g)+3H2O(g)��������ͼ��ʾ��
C2H5OH(g)+3H2O(g)��������ͼ��ʾ��
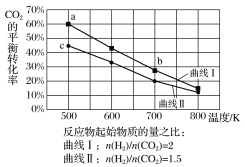
����˵����ȷ���ǣ� ��
A.�÷�ӦΪ���ȷ�Ӧ
B.��ƽ��ʱ��v��(H2)=v��(CO2)
C.b���Ӧ��ƽ�ⳣ��Kֵ����c��
D.a���Ӧ��H2��ƽ��ת����Ϊ90%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��Ϊ��̽�����������������������ʵ�鷽����
��֪�����������백����Ӧ2Al+2NH3![]() 2AlN+3H2��
2AlN+3H2��
�ڵ����������ȶ�����������ˮ���ᷴӦ���ڼ���ʱ����Ũ��ɲ���������
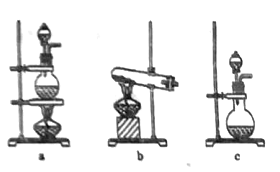
(1)��ͼ��ʵ�����Ʊ������ij��÷���װ�ã���ѡ��װ��b����÷���װ���еĻ�ѧ��Ӧ����ʽΪ��___________________________��
(2)����װ��c�Ľ�������ͼ��ʾ���Ӻ�װ�ã����װ�������ԣ���������ƿ�м�����ʯ�ң���Һ©���м���Ũ��ˮ��װ��G��ʢװ��ʯ�ң�װ��H�м������ۡ���װ��F����Һ©����������װ���п����ž����ٵ�ȼװ�DH���ƾ��ơ�
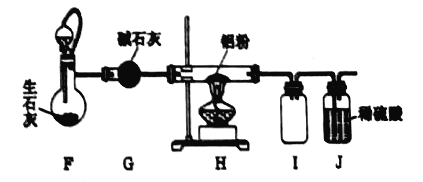
��װ��F��װ��c��ȵ��ŵ㣺 ____________________________��
����ƽ���ƶ�ԭ������װ��F�в���������ԭ�� __________________________��
��Ϊ�˵õ������ĵ��������ɽ�װ��H�й�����ȴ��ת�����ձ��У�����_______�ܽ⡢__________(���������)��ϴ�ӡ����T�ɡ�
�ܵ�����������������Һ���ȷ�Ӧ�����ӷ���ʽ�� __________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
����ͼ 1 ��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£�������� Cu ���缫����__������ĸ��ţ���
A �� B ʯī C �� D ��
��2��N ��������Ӧ�ĵ缫��ӦʽΪ__��
����ͼ 2 ��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣 �������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��3���������У�X ������Һ�� pH__����������������С����������������
��4���������У�Y �������ĵ缫��Ӧ֮һΪ Fe��6e��+8OH��= FeO42-+4H2O ���� X ���ռ���672 mL ���壬�� Y ���ռ��� 168 mL ���壨��������Ϊ��״��ʱ������������� Y �缫�����缫����������____g��
��5���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��������ķ�Ӧװ����ͼ��ʾ������֮һ�ǽ�����a��Ũ�����Ũ�����γɵĻ�����뵽װ�б���������ƿ�У���������������ȷ���ǣ� ��
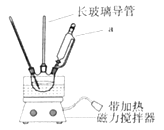
A.����a�������Ǻ�ѹ��Һ©��
B.���������ܿ�������������������
C.���ƻ���ʱӦ���ձ����ȼ���Ũ����
D.���������������Ҫ�����Ƿ�Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����зḻ�������Դ���༰�仯���ﱻ�㷺Ӧ���ڻ�е���ϡ����ϡ���ȼ�������Ӽ�����������ʮ����Ҫ�ļ�ֵ�����ô���Ǧ�ྫ����Ҫ�ɷ���Sb2S3��PbS���Ʊ���ף�Sb2O3���Ĺ���������ͼ��ʾ��
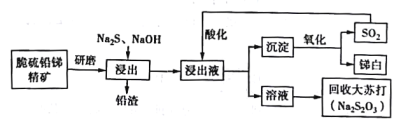
��֪��������ӦSb2S3+3Na2S = 2Na3SbS3
�ữ��Ӧ4Na3SbS3 +9SO2=6Na2S2O3+3S��+2Sb2S3��
�ش��������⡣
(1)���������ĥ��Ŀ����___________________��
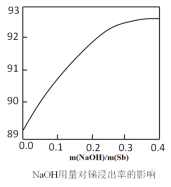
(2)�ڽ�����Ӧ�У���������NaOH�����ı仯������ͼ��ʾ������NaOH��������_______________________��
(3)�����Һ��ͨ��SO2��������ữ���õ�Sb2S3�м��塣�ữ��Ӧ�����У�pH��������ʼ��ữ����Һ��Na2S2O3������Ӱ�����±���ʾ���������˵�pHΪ__________�� pH���ܹ��͵�ԭ����_______________��������ӷ���ʽ˵������
pH | �ữ����Һ�ɷ�/��g��L-1�� | ��ij�����/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)����Һ�ữ����ˣ��õ����������ڸ����±�������д�����з�Ӧ�Ļ�ѧ����ʽ��_____________��
(5)��β�������ĽǶ����۸ù��������ڻ���������ŵ���__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com