
【题目】已知反应2NO2N2O4(g) H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
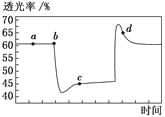
A.b 点的操作是压缩注射器
B.c 点与a点相比,c(NO2)增大、c(N2O4)减小
C.d 点:υ(正)<υ(逆)
D.若在c点将温度降低,其透光率将增大
【答案】B
【解析】
温度不变时,压缩体积,压强增大,虽然平衡正向移动,但是NO2和N2O4的浓度均增大,颜色变深,透光率降低,因此b点为压缩体积的点,同理透光率突然增大,是拉伸,扩大了体积。
A.b点开始透光率陡然下降,压缩体积,NO2浓度增大,导致透光率降低,A正确;
B.图中c点为压缩体积后的再次建立过程平衡,由于压缩体积,因此NO2和N2O4的浓度均增大,因此c(NO2)比a点大,c(N2O4)也同样应比原来的大,B不正确;
C.d点透光率正在减小,c(NO2)增大,平衡逆向移动,则v(正)<v(逆),C正确;
D.该反应为放热反应,降低温度,平衡正向移动,c(NO2)降低,则透光率将增大,D正确;
故选B。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】对氨基水杨酸钠(PAS-Na)是抑制结核杆茵最有效的药物。某同学设计的合成PAS-Na的两种路线如下:
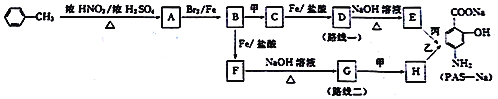
已知以下信息:
①甲、乙、丙为常用的无机试剂;
②![]()
③![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)甲和丙的名称分别是_________________、____________________。
(2)E的结构简式是______________________。
(3)A→B的化学方程式是______________________________________,反应类型是______。
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应的有____种,其中核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为___________。
(5)有同学认为“路线二”不合理,不能制备PAS-Na,你的观点及理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验:

(1)先关闭活塞a,将6.4g铜片和10mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:打开活塞a之前______________;打开活塞a之后______________;
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整______________;
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________(填化学式);
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用______________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为______________;再求出余酸的物质的量,若耗去amol/L氢氧化钠溶液bmL,则原余酸的物质的量为______________mol(用含a、b的表达式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() =1×10-12的溶液:Na+、K+、ClO-、CO32-
=1×10-12的溶液:Na+、K+、ClO-、CO32-
B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C. 能溶解Al(OH)3的溶液:K+、NH4+、NO3—、CH3COO—
D. 0.1mol/LFe(NO3)2溶液:H+、Cu2+、SO42—、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 固体表面水膜的酸性很弱或呈中性,发生吸氧腐蚀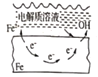
B. 钢铁表面水膜的酸性较强,发生析氢腐蚀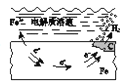
C. 将锌板换成铜板对钢闸门保护效果更好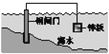
D. 钢闸门作为阴极而受到保护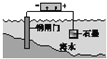
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。C02是目前大气中含量最高的一种温室气体,C02的综合利用是解决温室及能源问题的有效途径。
(1)研究表明C02和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:CH3OH(g)+![]() O2(g)= CO2(g)+2H2O(g)△H1=akJmol-,H2(g)+
O2(g)= CO2(g)+2H2O(g)△H1=akJmol-,H2(g)+![]() O2(g)=H2O(l)△H2,则CO2(g)+3H2(g)= CH3OH(g)+2H2O(l)△H=___kJmol-。
O2(g)=H2O(l)△H2,则CO2(g)+3H2(g)= CH3OH(g)+2H2O(l)△H=___kJmol-。
(2)C02催化加氢也能合成低碳烯烃:2C02(g)+6H2(g) =C2H4(g)+4H20(g),不同温度下 平衡时的四种气态物质的物质的量如图所示,曲线c表示的物质为____(填化学式)。

(3)C02和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A: C02(g)+3H2(g) = CH30H(g)+H20(g)
反应B: C02(g)+H2(g)=C0(g)+H20(g)
控制C02和H2初始投料比为1 : 3时,温度对C02平衡转化率及甲醇和CO产率的影响如图所示。
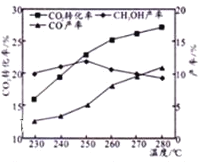
①由图可知温度升高CO的产率上升,其主要原因可能是________。
②由图可知获取CH3OH最适宜的温度是____________。下列措施不能提高C02转化为CH3OH的平衡转化率的有______(填字母)。
A.使用催化剂 B.增大体系压强 C.增大C02和出的初始投料比
(4)在催化剂表面通过施加电压可将溶解在酸性溶液中的二氧化碳直接转化为乙醇,则生成 乙醇的电极反应式为_________。
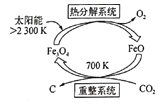
(5)由C02制取C的太阳能工艺如图所示。“热分解系统”发生的反应为 2Fe304 ![]() 6Fe0+02↑。毎分解1mo;Fe304转移电子的物质的量为______;“重整系统”发生反应的化学方程式为_______。
6Fe0+02↑。毎分解1mo;Fe304转移电子的物质的量为______;“重整系统”发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )

A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、镁、铝的单质及其化合物是中学阶段重点研宄的物成.
(1)按性质分类,Na2O2____________(填“属于”或“不属于”)碱性氧化物。
(2)用离子方程式说明Al(OH)3是两性氢氧化物: ____________________。
(3)某同学用如图所示装置进行实验探究有关钠、镁、铝的化合物的性质(夹持仪器省略)。将液体A遂满加入到固体B中,回答下列问题:
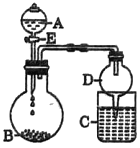
①若A为70%硫酸溶液,B为Na2SO3,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中发生反应的化学方程式为________________________。
②若A为水,B为Mg3N2,C中盛有AlC13溶液,旋开E,足够长的时间后,C中发生反应的离子方程式为__________________________。
③若A为浓盐酸,B为NaClO3,C中盛有KI-淀粉溶液,旋开E后,C中的现象是________________,继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式: _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com