
【题目】已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )

A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7molL-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是_____。BaO2的电子式为:__________。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
![]()
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为_____________。
②操作a是__________________。
③再生回收液的成分是______________________。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为____,该样品中H2O2的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2NO2N2O4(g) H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
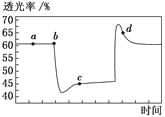
A.b 点的操作是压缩注射器
B.c 点与a点相比,c(NO2)增大、c(N2O4)减小
C.d 点:υ(正)<υ(逆)
D.若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:

①则25℃时水的电离平衡曲线应为_____。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____。
(3)下列说法中正确的是_____。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH-=![]() +2H2O
+2H2O
C.下列四种离子因发生氧化还原反应而不能大量共存:K+、Fe3+、SCN-、Cl-
D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++![]() =2H2O+BaSO4↓
=2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
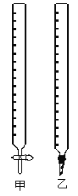
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3-
C. 加热可增强纯碱溶液去污能力:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. 用惰性电极电解CuSO4溶液: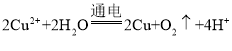
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途,用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
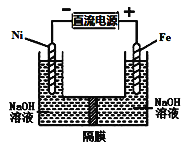
A.镍电极上的电极反应为2H2O+2e-![]() H2↑+2OH-
H2↑+2OH-
B.铁是阳极, 电极反应为Fe-2e-+OH-![]() Fe(OH)2
Fe(OH)2
C.若隔膜为阴离子交换膜, 则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高, 最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )
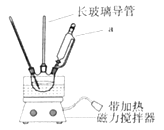
A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com