
【题目】(1)内因:___________________。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________,原因是_____________________________。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________,例如NaHCO3溶液显碱性,原因是_________________,_______________________________(离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________,_____________________(离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O![]() CH3COOH+OH-_______________
CH3COOH+OH-_______________
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | ||||
通入HCl | ||||
升温 | ||||
加水 | ||||
加NaOH | ||||
加HAc | ||||
加NH4Cl |
【答案】盐本身的性质 盐的浓度越小,水解程度越大 水解反应为吸热反应,升温促进水解 酸性 强酸酸式盐由于酸根电离大于水解,释放H+ 水解和电离的相对大小 NaHCO3溶液中水解程度大于电离程度 HCO3-+H2OH2CO3+OH-、HCO3- CO32-+H+ NaHSO3溶液中电离程度大于水解程度 HSO3-+H2OH2SO3+OH-、HSO3- SO32-+H+
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | → | ↑ | ↑ | ↑ |
通入HCl | → | ↓ | ↓ | ↑ |
升温 | → | ↓ | ↑ | ↑ |
加水 | → | ↓ | ↓ | ↑ |
加NaOH | ← | ↑ | ↑ | ↓ |
加HAc | ← | ↑ | ↓ | |
加NH4Cl | → | ↓ | ↓ | ↑ |
【解析】
(1) 影响盐类水解的内因素是盐本身的性质,据此分析;
(2)影响盐类水解的外因:浓度:盐的浓度越小,水解程度越大;温度:水解反应为吸热反应,升温促进水解;酸碱度:加入酸或碱能促进或抑制盐类的水解, 据此分析;
(3)强酸酸式盐由于酸根电离大于水解,释放H+;多元弱酸酸式盐溶液的酸碱性取决于水解和电离的相对大小,据此分析;
(4)根据勒夏特列原理和平衡CH3COO-+H2O![]() CH3COOH+OH-分析。
CH3COOH+OH-分析。
(1)影响盐类水解的内因素是盐本身的性质,故答案为:盐本身的性质;
(2)影响盐类水解的外因:浓度:盐的浓度越小,水解程度越大;温度:水解反应为吸热反应,升温促进水解;酸碱度:加入酸或碱能促进或抑制盐类的水解;故答案为:盐的浓度越小,水解程度越大;水解反应为吸热反应,升温促进水解;
(3) 强酸酸式盐由于酸根电离大于水解,释放H+,于是呈酸性;多元弱酸酸式盐溶液的酸碱性取决于水解和电离的相对大小,NaHCO3溶液显碱性,原因是HCO3-水解,反应为:HCO3-+H2OH2CO3+OH-,溶液呈碱性,同时溶液中也存在电离,电离方程式为:HCO3- CO32-+H+,溶液呈酸性,由于NaHCO3溶液中水解程度大于电离程度,因此显碱性;NaHSO3溶液显酸性的原因是HSO3-水解,反应为:HSO3-+H2OH2SO3+OH-,溶液呈碱性,同时溶液中也存在电离,电离方程式为:HSO3- SO32-+H+,溶液呈酸性,由于NaHSO3溶液中电离程度大于水解程度,因此显酸性;故答案为:酸性;强酸酸式盐由于酸根电离大于水解,释放H+;水解和电离的相对大小;NaHCO3溶液中水解程度大于电离程度;HCO3-+H2OH2CO3+OH-、HCO3- CO32-+H+;NaHSO3溶液中电离程度大于水解程度;HSO3-+H2OH2SO3+OH-、HSO3- SO32-+H+。
(4)在水解平衡 CH3COO-+H2O![]() CH3COOH+OH-中,加入CH3COONa,相当增大c(CH3COO-),促进平衡右移,水解程度增大,c(OH-)增大;通入HCl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;升温,水解过程吸热,因此升温促进平衡右移,水解程度增大,c(CH3COO-)减小,c(OH-)增大;加水,相当于溶液中所有离子都被稀释,越稀越水解,平衡右移,水解程度增大,但c(CH3COO-)减小,c(OH-)减小;加NaOH,相当于增大c(OH-),促进平衡左移,水解程度减小,c(CH3COO-)增大;加HAc,相当于增大c(CH3COOH),平衡左移,水解程度减小,c(CH3COO-)增大,c(OH-)减小;加NH4Cl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;故答案为:
CH3COOH+OH-中,加入CH3COONa,相当增大c(CH3COO-),促进平衡右移,水解程度增大,c(OH-)增大;通入HCl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;升温,水解过程吸热,因此升温促进平衡右移,水解程度增大,c(CH3COO-)减小,c(OH-)增大;加水,相当于溶液中所有离子都被稀释,越稀越水解,平衡右移,水解程度增大,但c(CH3COO-)减小,c(OH-)减小;加NaOH,相当于增大c(OH-),促进平衡左移,水解程度减小,c(CH3COO-)增大;加HAc,相当于增大c(CH3COOH),平衡左移,水解程度减小,c(CH3COO-)增大,c(OH-)减小;加NH4Cl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;故答案为:
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | → | ↑ | ↑ | ↑ |
通入HCl | → | ↓ | ↓ | ↑ |
升温 | → | ↓ | ↑ | ↑ |
加水 | → | ↓ | ↓ | ↑ |
加NaOH | ← | ↑ | ↑ | ↓ |
加HAc | ← | ↑ | ↓ | ↓ |
加NH4Cl | → | ↓ | ↓ | ↑ |
。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
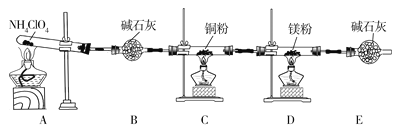
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
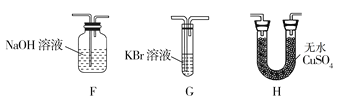
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
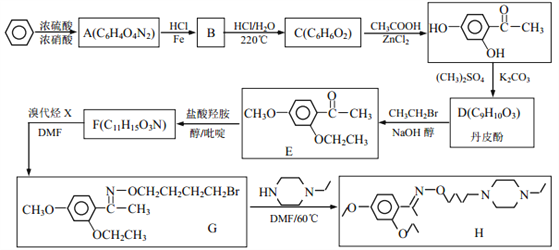
【题目】乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活性,是良好的心脑血管疾病的治疗药物。
已知:①![]()
②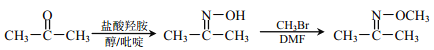
③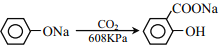
请回答:
(1)E中含有的官能团名称为_________;
(2)丹皮酚的结构简式为_________;
(3)下列说法不正确的是(___)
A.乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3
B.物质B 可能溶于水,且能与盐酸反应生成有机盐
C. D→E 和 G→H 的反应类型均为取代反应
D.物质 C 能使浓溴水褪色,而且 1mol C 消耗 2molBr2
(4)写出 F→G 的化学方程式_________。
(5)写出满足下列条件 F 的所有同分异构体的结构简式_________。
①能发生银镜反应;1molF 与 2molNaOH恰好反应。
②1H-NMR 谱显示分子中含有 5 种氢原子; IR 谱显示有-NH2,且与苯环直接相连。
(6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合理的路线制备阿司匹林( )。(用流程图表示,无机试剂任选)______。
)。(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法正确的是
A.常温下,1 L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
B.常温下,10 mL 5.6 mol/L FeC13溶液滴到100 mL沸水中,生成胶粒数为0.056NA
C.向Na2O2通入足量的水蒸气,固体质量增加bg,该反应转移电子数为![]()
D.6.8 g KHSO4晶体中含有的离子数为0.15 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种将电解饱和食盐水与电催化还原CO2相耦合的电解装置如图所示。下列叙述错误的是
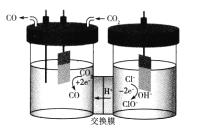
A.理论上该转化的原子利用率为100%
B.阴极电极反应式为![]()
C.Na+也能通过交换膜
D.每生成11.2 L(标况下)CO转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过FeCl3 溶液蒸干制得固体_________,原因是_____________________;继续灼烧产物是_____________ ,原因是 __________________________(离子方程式和文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M可用作消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如图:
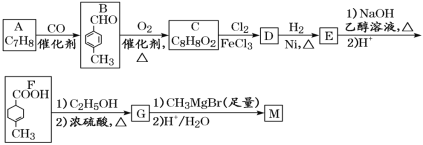
已知:R1COOR2
请回答:
(1)C的化学名称为___;D中含氧官能团的结构简式为___。
(2)由B转化为C的反应类型为___;G的分子式为___。
(3)由E转化为F的第一步反应的化学方程式为___。
(4)M的结构简式为___。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式___。
(6)参照上述合成路线和信息,以苯甲酸甲酯和CH3MgBr为原料(无机试剂任选),设计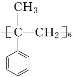 制备的合成路线___。
制备的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390 ℃,沸点是430 ℃,溶于冷水,遇热水则强烈水解。在380~400 ℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。
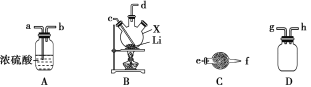
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是__________(填字母)。
A. 浓氨水、CaO B. NH4Cl固体、Ca(OH)2固体
C. 浓氨水 D. NH4NO3固体、NaOH固体
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为__________(填接口处字母),装置A的作用是__________。
(3)装置C中仪器的名称是___________,盛装的试剂是___________。实验开始后,向X中通入NH3与加热仪器X的先后顺序为___________。
(4)实验室还可用浓氨水与固体NaOH混合制备氨气,但多次实验表明,此方法收集到的NH3量总是比理论值低许多,其最可能的原因是_________。
(5)氨基锂能与热水反应生成LiOH与一种气体,请推测该气体的成分并用实验验证你的结论:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com