
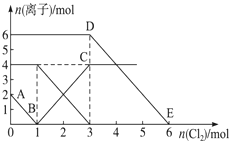
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br﹣═2Cl﹣+Br2,2Fe2++Br2═2Fe3++2Br﹣,2Fe3++2I﹣═2Fe2++I2.则下列说法中不正确的是( )
|
| A. | 还原性:I﹣>Fe2+>Br﹣ |
|
| B. | 原混合溶液中FeBr2的物质的量为3mol |
|
| C. | 线段AB表示Fe2+被氯气氧化 |
|
| D. | 原溶液中:n(Fe2+):n(I﹣):n(Br﹣)═2:1:3 |
| 离子方程式的有关计算. . | |
| 专题: | 计算题. |
| 分析: | 氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,据此回答判断. |
| 解答: | 解:A、反应2Fe2++Br2=2Fe3++2Br﹣中,还原剂Fe2+的还原性强于还原产物Br﹣,所以还原性:Fe2+>Br﹣,反应2Fe3++2I﹣=2Fe2++I2中,还原剂I﹣的还原性强于还原产物Fe2+,所以还原性:I﹣>Fe2+,所以还原性I﹣>Fe2+>Br﹣,故A正确; B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B正确; C、通入氯气后,碘离子先被氧化,线段AB即在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,表示I﹣被氯气氧化,故C错误; ,通入氯气的量为1~3mol的过程中,D、碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I﹣):n(Br﹣)=2:1:3,故D正确. 故选C. |
| 点评: | 本题考查学生氧化还原反应中氧化性和还原性强弱的知识,综合性较强,难度较大. |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
A.浓硫酸与水 B.生石灰与水 C.熟石灰与水 D.氯化钠与水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氮族元素的氢化物中,NH3的沸点最低
B.非金属性:Cl > Br > I,所以酸性:HCl > HBr > HI
C.Na和Cs同主族,所以NaCl和CsCl晶胞的结构相同
D.O和S同主族,所以CO2和CS2都是直线型非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中(不考虑电解),必须加入氧化剂才能实现的是( )
|
| A. | Cl﹣→Cl2 | B. | Fe3+→Fe2+ | C. | Al3+→AlO2﹣ | D. | H2O2→O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在烧杯中加入水和煤油(密度:0.88g/cm3)各50mL,将一小粒金属钠(密度:0.97g/cm3)投入烧杯中,观察到的现象可能是( )
|
| A. | 钠在水层中反应并四处游动 |
|
| B. | 钠停留在煤油层中不发生反应 |
|
| C. | 钠在煤油的液面上反应并四处游动 |
|
| D. | 钠在煤油与水的界面处反应并可能作上、下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度.(可供选用的试剂只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)请回答下列问题:
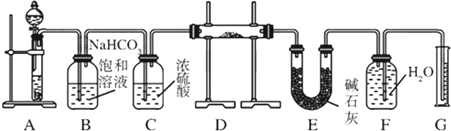
(1)装置A中的液体试剂选用 6 mol/L盐酸 ,理由是: 硫酸与CaCO3反应生成微溶的CaSO4,覆盖在CaCO3表面,使反应终止 ;
(2)装置B的作用是 除去气体中的HCl ,装置E中碱石灰的作用是: 吸收未反应的CO2 ;
(3)若开始时测得样品的质量为2.0g,反应结束后测得生成气体的体积为224mL(标准状况),计算出试样中Na2O2的纯度: 78% .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方法或数据合理的是
A.用10mL量筒量取7.50mL稀盐酸
B.用25mL碱式滴定管准确量取22.00 mL的KMnO4溶液
C.用广泛pH试纸测出某盐酸溶液的pH为3.2
D.用托盘天平准确称取9.8g NaCl 固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com