
【题目】如表列出了①~⑥六种元素在元素周期表中的位置.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是 (填写元素符号);
(2)元素①③⑥的氢化物的分子式分别是 ; ; .
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是 .
【答案】(1)F(2)CH4;HF;H2S(3)Al(OH)3+OH﹣═AlO2﹣+2H2O
【解析】解:由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)①、②、③同周期,原子序数依次增大,自左而右元素非金属性增强,故F元素非金属性最强,故答案为:F;
(2)元素①③⑥分别为:C、F、S,它们的最低负化合价分别为﹣4、﹣1、﹣2,其氢化物化学式为CH4、HF、H2S,故答案为:CH4;HF;H2S;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣═AlO2﹣+2H2O.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到平衡,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
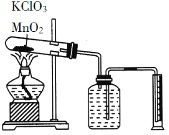
实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5-氨基四唑(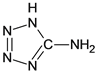 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为__________;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为__________;在1mol 5-氨基四唑中含有的σ键的数目为__________.
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为__________.
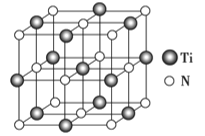
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化 钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为__________.
③[Ti(OH)2(H2O)4]2+中的化学键有__________.
a.σ键 b.π键 c.离子键 d.配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)下列六种生活中常见物质:
①食盐 ②食用油 ③靑霉素 ④鸡蛋 ⑤西红柿 ⑥塑料
按要求用物质序号填空:
作调味剂的是___________;作抗生素的是___________;富含蛋白质的是___________;富含维生素的是___________;富含油脂的是___________;属于合成材料的是___________。
(2)一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+, 有利于人体吸收。
i.在人体中进行Fe2+ ![]() Fe3+的转化时,①中的Fe2+作________ (填“氧化剂”或“还原剂”),②中的Fe3+作________ (填“氧化剂”或“还原剂”)。
Fe3+的转化时,①中的Fe2+作________ (填“氧化剂”或“还原剂”),②中的Fe3+作________ (填“氧化剂”或“还原剂”)。
ii.服用维生索C,可使食物中的Fe3+还原成Fe2+这句话指出,维生素C在这一反应中作 ____________(填“氧化剂”或“还原剂”)
iii.市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸 (HC1)的作用下转化成亚铁盐。此反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯的反应中属于加聚反应的是( )
A. 在空气中完全燃烧
B. 在一定条件下生成聚乙烯
C. 使溴的四氯化碳溶液褪色
D. 使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示取1 mol己烯雌酚进行的四个实验,下列对实验数据的预测与实际情况吻合的是

A. ①中生成7 mol H2O B. ②中生成2 mol CO2
C. ③中最多消耗3 mo1 Br2 D. ④中最多消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为________________________。放电一段时间后,负极附近溶液的pH________(填“升高”“降低”或“不变”)。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,其反应的化学方程式为________________________。请把该反应设计成一个原电池,在方框内面出原电池装置图(要求:标明电极材料和电解质溶液)。_______

(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。
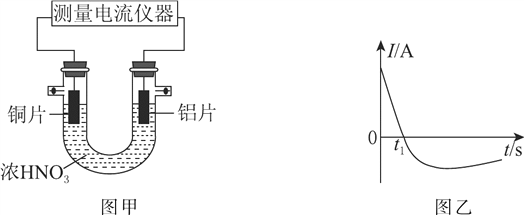
t1s前,原电池的负极是铝片,正极的电极反应式为____________,溶液中的H+向________(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生的反应类型和反应条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com