
【题目】在一个密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) 。已知反应过程中某一时刻,SO2、O2、SO3分别是2mol/L、1mol/L、2mol/L,当反应达到平衡时,可能存在的数据是( )
2SO3(g) 。已知反应过程中某一时刻,SO2、O2、SO3分别是2mol/L、1mol/L、2mol/L,当反应达到平衡时,可能存在的数据是( )
A.SO2为4mol/L,O2为2mol/LB.SO2为2.5mol/L
C.SO2、SO3均为1.5mol/LD.SO3为4mol/L
【答案】B
【解析】
极限思维转化,正向转化
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量 2 mol/L 1 mol/L 2 mol/L
转化量 2 mol/L 1 mol/L 2 mol/L
后来量 0 0 4 mol/L
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量 2 mol/L 1 mol/L 2 mol/L
转化量 2 mol/L 1 mol/L 2 mol/L
后来量 4 mol/L 2 mol/L 0
A选项,SO2不能为端点值4mol/L,故A错误;
B选项,SO2为2.5mol/L,在最小值和最大值之间,故B正确;
C选项,SO2为1.5mol/L时,SO3为2.5mol/L,不是1.5mol/L,故C错误;
D选项,SO3不能为端点值4mol/L,故D错误;
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西安兵马佣二号坑出土的宝剑因含有铬而锋利无比。目前,工业用硬铬尖晶石(属于含氧酸盐,主要含MN2O4其中M代表Mg或Fe,N代表Cr或Al)制备重铬酸钠(工业流程如图),同时电解重铬酸钠溶液便可得到铬。
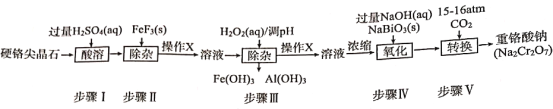
(1)硬铬尖晶石中,Cr的化合价为__。
(2)在步骤II中除去的离子是___,操作X的名称为___。
(3)写出步骤III中H2O2表现的性质是___,已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为___。(常温下:[Ksp[Cr(OH)3]=1.0×10-32,Ksp[Al(OH)3]=1.0×10-35,Ksp[Fe(OH)3]=1.0×10-38]。
A.10~11 B.>11 C.约为10 D.约为4
(4)已知NaBiO3和Bi(OH)3都是难溶于水的固体。在步骤IV中发生化学反应的离子方程式为___,步骤V中CO2压强越大Na2Cr2O7产率越高,其原因是___。
(5)工业上用电解法制备铬,其装置示意图如图:
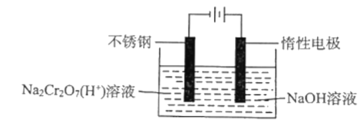
电解池工作时,阴极发生的电极反应式为___,该装置的电能主要转变为___能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为3O2![]() 2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B.太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源
C.吸热反应就是反应物的总能量比生成物的总能量小的反应;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少的反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=-566.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00mL浓度均为0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;巳知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NHH2O]=l.60×l0-4。下列说法正确的是( )
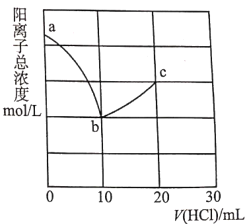
A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L
B.从a到c的过程中,水的电离程度最大的是b点
C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-)
D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NHH2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是学生课外实践活动的实验设计,其中不能达到们应的实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 除去乙酸乙酯中的乙酸 |
|
B | 证明氧化性:Cl2>I2 |
|
C | 用NaOH标准溶液滴定某稀盐酸 |
|
D | 探究锅炉里的水垢样品在酸中的溶解 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
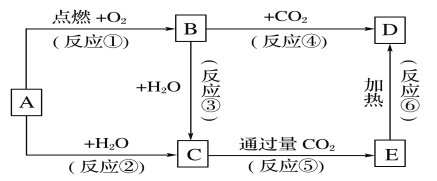
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
试写出由CH4和O2制取甲醇蒸气的热化学方程式:____。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______。
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______。
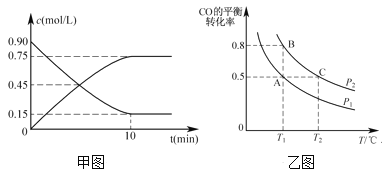
(3)在一容积可变的密闭容器中充入1 molCO和2mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是____。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为2L。如果反应开始时仍充入1molCO和2molH2,则在平衡状态B时容器的体积V(B)=___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com