
【题目】氯磺酸是无色液体,密度1.79g·cm-3,沸点约152℃。氯磺酸有强腐蚀性,遇湿空气产生强烈的白雾,故属于危险品。制取氯磺酸的典型反应是在常温下进行的,反应为 HCl(g)+SO3 = HSO3Cl。实验室里制取氯磺酸可用下列仪器装置(图中夹持、固定仪器等已略去),实验所用的试剂、药品有:①密度1.19g·cm-3浓盐酸 ②密度1.84g·cm-3、质量分数为98.3%的浓硫酸 ③发烟硫酸(H2SO4··SO3) ④无水氯化钙 ⑤水。制备时要在常温下使干燥的氯化氢气体和三氧化硫反应,至不再吸收HCl时表示氯磺酸已大量制得,再在干燥HCl气氛中分离出氯磺酸。
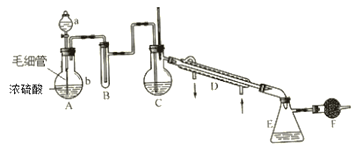
(1)仪器中应盛入的试剂与药品(填数字序号):A中的a____ B____ C_____ F_____ 。
(2)A的分液漏斗下边接有的毛细管是重要部件,在发生气体前要把它灌满a中液体,在发生气体时要不断地均匀放出液体。这是因为______________________________________。
(3)实验过程中需要加热的装置是___________________ (填装置字母)。
(4)若不加F装置,可能发生的现象是________________________________________, 有关反应的化学方程式______________________________________________________。
(5)在F之后还应加的装置是_______________________________________________。
【答案】① ② ③ ④ 使密度较浓硫酸小的浓盐酸顺利流到底部,能顺利产生HCl气体 C 产生大量白雾 HSO3Cl+H2O= H2SO4+HCl↑ 加一倒扣漏斗于烧杯水面上的吸收装置
【解析】
题中已经告知氯磺酸的一些性质及制备信息。要结合这些信息分析各装置的作用。制备氯磺酸需要HCl气体,则A为HCl气体的发生装置,浓硫酸吸水放热,可以加强浓盐酸的挥发性。B为浓硫酸,用来干燥HCl气体,因为氯磺酸对潮湿空气敏感。C为氯磺酸的制备装置,因为C有温度计,并连有冷凝装置,反应结束后可以直接进行蒸馏,所以C中装的物质是发烟硫酸。E用来接收氯磺酸。由于氯磺酸对潮湿空气敏感,F中要装无水氯化钙,以防止空气中的水蒸气进入装置中。
(1)A为HCl的发生装置,则a装①浓盐酸;B要干燥HCl气体,则B要装②浓硫酸;C为氯磺酸的发生装置,则C要装③发烟硫酸;F要装④无水氯化钙,以防止空气中的水蒸气进如装置;
(2)由题知,浓盐酸的密度比浓硫酸小,如果直接滴加,两种液体不能充分混合,这样得到的HCl气流不平稳。故题中的操作的目的是使密度较浓硫酸小的浓盐酸顺利流到底部,充分混合两种液体,能顺利产生HCl气体;
(3)C装置既是氯磺酸的发生装置,也是氯磺酸的蒸馏装置,所以C需要加热;
(4)若无F装置,则空气中的水蒸气会进入装置中,氯磺酸对水汽极为敏感,则可以看到产生大量白雾,方程式为HSO3Cl+H2O= H2SO4+HCl↑;
(5)实验中,不能保证HCl气体完全参加反应,肯定会有多于的HCl气体溢出,则需要尾气处理装置,由于HCl极易溶于水,最好加一倒扣漏斗于烧杯水面上的吸收装置。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力增强
B.铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关
C.将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3
D.将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.髙锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______________________________(用化学方程式表示)。
(2)第④步通人适量CO2,发生反应生成MnO4-、MnO2和碳酸盐,则发生反应的离子方程式为_______________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_________________(用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性髙锰酸钾溶液,则酸性髙锰酸钾溶液会褪色,写出该反应的离子方程式: ________________________________。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同______(填“相同”或“不相同”)。
(6)若装置B中装有5.0 mL 1.0 mol L-1的碘水,当通入足量Cl2完全反应后,共转移了5. 0×10-2 mol电子,则该反应的化学方程式为____________________________。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4 : 3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加人氯化钡溶液,有白色沉淀产生。 写出Cl2与含有X的溶液反应的离子方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
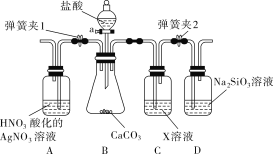
实验操作步骤:
①打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
②A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是___________。
(2)通过步骤①、②得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是__________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤②中未写的操作和现象是___________。
(5)D中反应的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种香料,可按如下路线合成:

已知:
i.A的核磁共振氢谱有2组峰,峰面积之比为9:1;E为芳香烃。
ii.R-CH=CH2 ![]() R-CH2CH2OH
R-CH2CH2OH
iii.同一个碳上连两个羟基通常不稳定,易脱水形成碳氧双键
iv.R1CHO+R2CH2CHO![]()
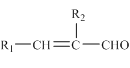
试回答下列问题:
(1)A的化学名称为____________,I中所含的含氧官能团为__________(填名称)。
(2)反应②的反应类型为____________。
(3)H的分子式为_________________。
(4)H与新制Cu(OH)2悬浊液反应的化学方程式为_______________。
(5)满足下列条件的I的同分异构体共有_____种(不含立体异构)。
①含有苯环和碳碳双键
②能够发生银镜反应和水解反应
写出同分异构体中核磁共振氢谱图有5组峰,且峰面积之比为1:1:2:2:2的结构简式:________。
(6)参照上述合成路线以乙醇和甲醛为原料(无机试剂任选),设计制备丙烯酸(CH2=CHCOOH)的合成路线。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气,下列关于Na2O2的叙述正确的是( )
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A.①③⑤B.②③⑤C.①②⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是

A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2在该反应中( )
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10L SO2就会放出2.5LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)积极保护生态环境可实现人与自然的和谐共处。
①下列做法会加剧温室效应的是__________(填字母)。
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是_____________(填字母)。
a.使用可降解塑料 b.露天焚烧废旧塑料 c.直接填埋废旧塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹。“禁止燃放烟花爆竹”的标识是_____(填字母)。

(2)合理使用化学知识可提高人们的生活质量。
某品牌牙膏的成分有甘油、山梨酸钾、氟化钠等。
①在上述牙膏成分中,属于防腐剂的是_______________。
②甘油的结构简式为____________;油脂水解可生成甘油和_____________。
③氟化钠(NaF)可与牙齿中的羟基磷酸钙[Ca5(PO4)3OH]反应,生成更难溶的氟磷酸钙[Ca5(PO4)3F],从而达到防治龋齿的目的。写出该反应的化学方程式:____________________。
(3)创新发展材料技术科推动人类社会的进步。
①石墨烯(见下图)可用作太阳能电池的电极,这里主要利用了石墨烯的______________性。

②基础工程建设中常用到水泥、玻璃、钢材等。生成水泥和玻璃都用到的原料是__________;在钢材中添加铬、镍等元素的目的是___________。
③新型战斗机常用纳米SiC粉体作为吸波材料。高温下焦炭和石英反应可制得SiC,石英的化学式为________________;高温分解Si(CH3)2Cl2也可制得SiC,同时还生成CH4和一种常见酸性气体,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com