
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中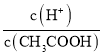 增大
增大
科目:高中化学 来源: 题型:
【题目】阳极泥处理后的沉渣中含AgCl,工业上可用Na2SO3溶液作浸取剂浸出回收。某小组在实验室模拟该过程。
已知:
i.25oC时,部分物质的溶解度:AgCl 1.9×10–4 g;Ag2SO3 4.6×10–4 g;Ag2SO4 0.84 g。
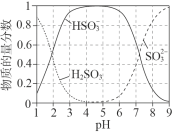
ii.25oC时,亚硫酸钠溶液酸化过中含![]() 微粒的物质的量分数随pH变化如图所示。
微粒的物质的量分数随pH变化如图所示。
Ⅰ.浸出氯化银
取AgCl固体,加入1 mol/L Na2SO3溶液作浸取剂,充分反应后过滤得到浸出液(pH=8),该过程中发生的反应为AgCl +![]()
![]() [Ag(SO3)2]3– + Cl–。
[Ag(SO3)2]3– + Cl–。
(1)用平衡移动原理解释AgCl溶解的原因是___。
Ⅱ. 酸化沉银
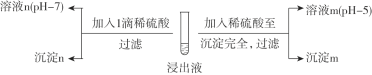
(2)经检测,沉淀m为AgCl,则溶液m中含![]() 微粒的主要存在形式是________。
微粒的主要存在形式是________。
(3)探究沉淀n的成分。
①甲同学认为沉淀n一定不含Ag2SO4,其依据是________。
②乙同学认为沉淀n可能含Ag2SO3,进行实验验证。
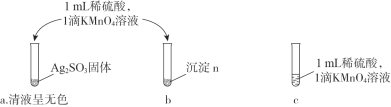
i. 本实验设计的依据是:Ag2SO3具有________性。
ii. 乙同学观察到________,得出结论“沉淀n不含Ag2SO3”。
③丙同学从溶液n的成分角度再次设计实验证明沉淀n不含Ag2SO3。

i. 本实验设计的依据是:若沉淀n含Ag2SO3,则溶液n中含![]() 微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
ii. 结合实验现象简述丙同学的推理过程:____。
Ⅲ.浸取剂再生
(4)溶液m经处理后可再用于浸出AgCl,请简述该处理方法____。
查看答案和解析>>
科目:高中化学 来源: 题型:
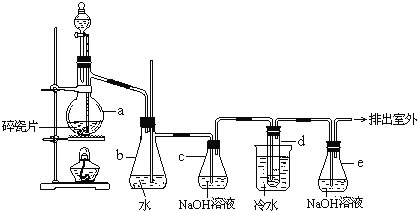
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18gcm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
完成下列填空:
(1)在此制备实验中,要尽可能迅速把反应温度升高到170℃左右,最主要目的是___________。
a. 引发反应 b. 加快反应速率 c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:_______________________;___________________________。
(3)安全瓶b可以防止倒吸,并可以检验实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象_________________________________________。
(4)容器c中NaOH溶液的作用是______________________________________。
(5)判断该制备反应已经结束的最简单方法是____________________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的一种原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是( )
A.小苏打与盐酸反应的离子方程式:CO32+H+=CO2↑+H2O
B.乙烯与氯化氢加成的化学方程式:CH2=CH2+HCl![]() CH3=CH2Cl
CH3=CH2Cl
C.碳酸钾在水中的电离方程式:K2CO3![]() 2K++CO32
2K++CO32
D.醋酸钠水解的离子方程式:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 用惰性电极电解 Na2SO4溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B. 用惰性电极电解 CuSO4溶液,当加入 1 mol Cu(OH)2恢复电解前浓度时,电路中转移了 4 mol e-
C. 用惰性电极电解 1 mol CuSO4和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D. 要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol甲醇分子中含有的共价键数为4NA
B.2.4 g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5NA
D.1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,解决下列问题:
(1)AgNO3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是______。
(2)今有常温下五种溶液:NH4Cl溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 NaOH溶液
①NH4Cl溶液的pH_____7(填“>”、“<”或“=”),升高温度可以_______(填“促进”或“抑制”)NH4Cl的水解;
②pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH_______NaOH溶液的pH(填“>”“=”或“<”);
③浓度相同的下列三种溶液:(A)NH4Cl溶液(B) (NH4)2SO4溶液(C)NH4HSO4 溶液,则c(NH4+)由大到小的顺序为____>___>____(用序号填空)。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,试解释原因________。 (提示:SOCl2与水反应的化学方程式为SOCl2 +H2O= SO2↑+ 2HCl↑)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的CuCl2产品投入Na2CO3溶液中,充分反应后得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:
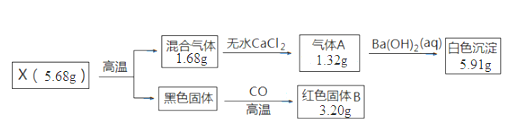
(1)混合气体的成分是__。
(2)X的化学式为__。
(3)写出CuCl2与Na2CO3反应生成X的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A.SO3 + H2O === H2SO4B.CaCO3 === CaO + CO2↑
C.Zn + H2SO4 === ZnSO4 + H2↑D.AgNO3 + NaCl![]() AgCl↓+ NaNO3
AgCl↓+ NaNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com