
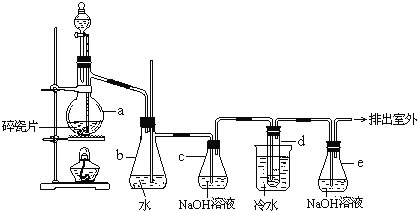
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18gcm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
完成下列填空:
(1)在此制备实验中,要尽可能迅速把反应温度升高到170℃左右,最主要目的是___________。
a. 引发反应 b. 加快反应速率 c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:_______________________;___________________________。
(3)安全瓶b可以防止倒吸,并可以检验实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象_________________________________________。
(4)容器c中NaOH溶液的作用是______________________________________。
(5)判断该制备反应已经结束的最简单方法是____________________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的一种原因__________________________。
【答案】d CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2Br b中水面会下降,玻璃管中的水柱会上升,甚至溢出 除去乙烯中带出的酸性气体或答除去CO2、SO2 溴的颜色完全褪去 ①乙烯发生(或通过液溴)速度过快②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当“亦可)
CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2Br b中水面会下降,玻璃管中的水柱会上升,甚至溢出 除去乙烯中带出的酸性气体或答除去CO2、SO2 溴的颜色完全褪去 ①乙烯发生(或通过液溴)速度过快②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当“亦可)
【解析】
a装置:实验室制取乙烯的方程式为CH3CH2OH![]() CH2=CH2↑+H2O,该反应对于温度有较高的要求,若温度过低,生成的是乙醚,若过高,则浓硫酸会氧化乙醇,生成二氧化硫和二氧化碳,其中二氧化硫能与溴水反应,干扰实验。两者都属于酸性气体,可以用NaOH溶液除去。b装置:装置中安全瓶b可以防止倒吸,也能检查实验进行时试管d是否发生堵塞,原理如下:①若安全瓶气压过小,则可通过玻璃管从外界吸入气体,保持内外压强相等,从而防止倒吸。②若试管d发生堵塞,安全瓶内部压强增大,玻璃管中的液面就会上升。c装置:除去酸性气体CO2、SO2防止干扰实验。d装置:乙烯与溴加成反应生成1,2-二溴乙烷,e装置:尾气处理装置溴有毒,需要使用尾气吸收装置,氢氧化钠溶液能够与溴反应。
CH2=CH2↑+H2O,该反应对于温度有较高的要求,若温度过低,生成的是乙醚,若过高,则浓硫酸会氧化乙醇,生成二氧化硫和二氧化碳,其中二氧化硫能与溴水反应,干扰实验。两者都属于酸性气体,可以用NaOH溶液除去。b装置:装置中安全瓶b可以防止倒吸,也能检查实验进行时试管d是否发生堵塞,原理如下:①若安全瓶气压过小,则可通过玻璃管从外界吸入气体,保持内外压强相等,从而防止倒吸。②若试管d发生堵塞,安全瓶内部压强增大,玻璃管中的液面就会上升。c装置:除去酸性气体CO2、SO2防止干扰实验。d装置:乙烯与溴加成反应生成1,2-二溴乙烷,e装置:尾气处理装置溴有毒,需要使用尾气吸收装置,氢氧化钠溶液能够与溴反应。
(1)该反应对于温度有较高的要求,若温度过低,生成的是乙醚,因此选d;
答案:d
(2)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O 、CH2=CH2+Br2→CH2BrCH2Br ;
CH2=CH2↑+H2O 、CH2=CH2+Br2→CH2BrCH2Br ;
答案:CH3CH2OH![]() CH2=CH2↑+H2O 、CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2↑+H2O 、CH2=CH2+Br2→CH2BrCH2Br
(3)安全瓶b可以防止倒吸,并可以检验实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
答案:b中水面会下降,玻璃管中的水柱会上升,甚至溢出
(4)容器c中NaOH溶液的作用是除去乙烯中带出的酸性气体,主要是二氧化硫能与溴水反应,干扰实验;
答案:除去乙烯中带出的酸性气体或答除去CO2、SO2
(5)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
答案: 溴的颜色完全褪去
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。①乙烯发生(或通过液溴)速度过快②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃,生成了副产物。
答案:乙烯发生(或通过液溴)速度过快②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当“亦可)


科目:高中化学 来源: 题型:
【题目】下图是一种新型消毒剂的结构式,其中,Y、Z、W处于不同短周期、不同主族,X、W的简单离子核外电子排布相同,X的最外层电子数恰好等于Y、Z、W的最外层电子数之和,下列说法中正确的是( )

A.在元素周期表中,Y 位于 IVA 族
B.原子序数大小关系: Z > W > X > Y
C.W 元素被称为“国防金属”
D.电解熔融的氯化钠可得到 Z 的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法正确的是
A.1mol Na2O2参与氧化还原反应,电子转移数一定为NA (NA为阿伏加德罗常数的值)
B.浓HCl和MnO2制氯气的反应中,参与反应的HCl中体现酸性和氧化性各占一半
C.VC可以防止亚铁离子转化成三价铁离子,主要原因是VC具有较强的还原性
D.NO2与水反应,氧化剂和还原剂的物质的量之比为2: 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示:
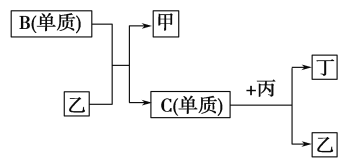
(1)写出B+乙→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号)
①A②B③C④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应
②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙→乙+丁的化学反应方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。下图表示的是向100 mL 0.02 mol·L-1 KAl(SO4)2溶液中逐滴加入0.05 mol·L-1 Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系。下列说法不正确的是
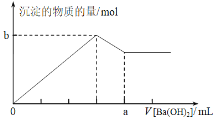
A.所加的Ba(OH)2溶液的pH=13
B.a点的值是80 mL
C.b点的值是0.005 mol
D.当V [Ba(OH)2]=30 mL时,生成沉淀的质量是0.699 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.常温下,0.1 mol·L-1CH3COONa溶液的pH=8,则该溶液中 c(CH3COOH)=(10-6-10-8)mol·L—1
B.对于相同浓度的弱酸HX和HY(前者的Ka较大)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值
C.硫酸钡固体在水中存在以下平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
D.常温下,a mol·L-1的CH3COOH溶液与0.01mol·L-1NaOH溶液等体积混合后溶液呈中性,此温度下醋酸的电离平衡常数Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中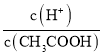 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡苯脲是一种西瓜膨大剂(植物生长调节剂),其组成结构和物理性质见下表。
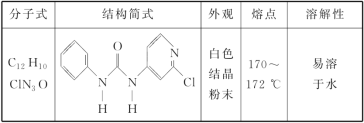
回答下列问题:
(1)氯吡苯脲晶体中,氮原子的杂化轨道类型为________。
(2)氯吡苯脲晶体中,微粒间的作用力类型有________。
A.离子键 B.金属键
C.极性键 D.非极性键
E.配位键 F.氢键
(3)查文献可知,可用2-氯-4-氨吡啶与异氰酸苯酯反应,生成氯吡脲。

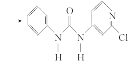
反应过程中,每生成1 mol氯吡苯脲,断裂________个σ键、断裂________个π键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com