
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】高纯氢的制备是目前的研究热点,利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。下列有关说法正确的是
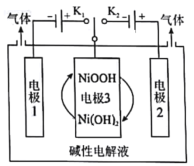
A.连接K1可以制取O2
B.电极2发生反应2H2O+2e-=H2↑+2OH-
C.电极3的主要作用是通过NiOOH和Ni(OH)2相互转化提供电子转移
D.连接K2溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
下列措施中,能提高CH3OCH3产率的有____。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H < 0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳极泥处理后的沉渣中含AgCl,工业上可用Na2SO3溶液作浸取剂浸出回收。某小组在实验室模拟该过程。
已知:
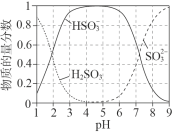
i.25oC时,部分物质的溶解度:AgCl 1.9×10–4 g;Ag2SO3 4.6×10–4 g;Ag2SO4 0.84 g。
ii.25oC时,亚硫酸钠溶液酸化过中含![]() 微粒的物质的量分数随pH变化如图所示。
微粒的物质的量分数随pH变化如图所示。
Ⅰ.浸出氯化银
取AgCl固体,加入1 mol/L Na2SO3溶液作浸取剂,充分反应后过滤得到浸出液(pH=8),该过程中发生的反应为AgCl +![]()
![]() [Ag(SO3)2]3– + Cl–。
[Ag(SO3)2]3– + Cl–。
(1)用平衡移动原理解释AgCl溶解的原因是___。
Ⅱ. 酸化沉银
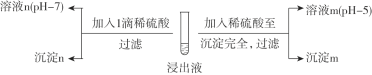
(2)经检测,沉淀m为AgCl,则溶液m中含![]() 微粒的主要存在形式是________。
微粒的主要存在形式是________。
(3)探究沉淀n的成分。
①甲同学认为沉淀n一定不含Ag2SO4,其依据是________。
②乙同学认为沉淀n可能含Ag2SO3,进行实验验证。
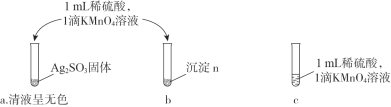
i. 本实验设计的依据是:Ag2SO3具有________性。
ii. 乙同学观察到________,得出结论“沉淀n不含Ag2SO3”。
③丙同学从溶液n的成分角度再次设计实验证明沉淀n不含Ag2SO3。

i. 本实验设计的依据是:若沉淀n含Ag2SO3,则溶液n中含![]() 微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
ii. 结合实验现象简述丙同学的推理过程:____。
Ⅲ.浸取剂再生
(4)溶液m经处理后可再用于浸出AgCl,请简述该处理方法____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
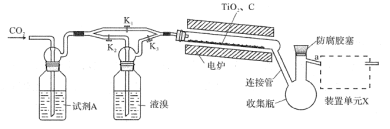
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素![]() 在表中的位置,用 化 学 用 语回答下列问题:
在表中的位置,用 化 学 用 语回答下列问题:
族 周期 | IA | 0 | ||||||
1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 |
|
|
| |||||
3 |
|
|
|
| ||||
![]() 的原子结构示意图为_________。
的原子结构示意图为_________。
![]() 的气态氢化物分子的结构式为_____________。
的气态氢化物分子的结构式为_____________。
![]() 、
、![]() 的最高价含氧酸的酸性由强到弱的顺序是________________。
的最高价含氧酸的酸性由强到弱的顺序是________________。![]() 填化学式
填化学式![]()
![]() 、
、![]() 元素的金属性强弱依次为___________。
元素的金属性强弱依次为___________。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 、
、![]() 的形成的简单离子半径依次_______。
的形成的简单离子半径依次_______。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18gcm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
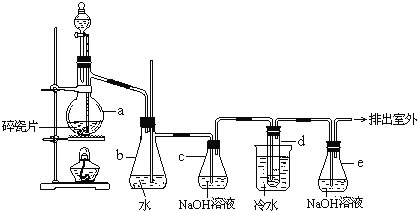
完成下列填空:
(1)在此制备实验中,要尽可能迅速把反应温度升高到170℃左右,最主要目的是___________。
a. 引发反应 b. 加快反应速率 c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:_______________________;___________________________。
(3)安全瓶b可以防止倒吸,并可以检验实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象_________________________________________。
(4)容器c中NaOH溶液的作用是______________________________________。
(5)判断该制备反应已经结束的最简单方法是____________________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的一种原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,解决下列问题:
(1)AgNO3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是______。
(2)今有常温下五种溶液:NH4Cl溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 NaOH溶液
①NH4Cl溶液的pH_____7(填“>”、“<”或“=”),升高温度可以_______(填“促进”或“抑制”)NH4Cl的水解;
②pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH_______NaOH溶液的pH(填“>”“=”或“<”);
③浓度相同的下列三种溶液:(A)NH4Cl溶液(B) (NH4)2SO4溶液(C)NH4HSO4 溶液,则c(NH4+)由大到小的顺序为____>___>____(用序号填空)。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,试解释原因________。 (提示:SOCl2与水反应的化学方程式为SOCl2 +H2O= SO2↑+ 2HCl↑)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com