
| A. | 蛋白质的变性 | B. | 蛋白质的盐析 | C. | 胶体聚沉 | D. | 盐类水解 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,则Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 | |
| C. | CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 | |
| D. | 已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
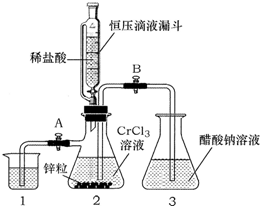 酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:
酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用(NH4)2Fe(SO4)2 溶液与过量NaOH反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | |
| B. | 用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 向小苏打溶液中加入少量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| D. | 向NaClO溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 3 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
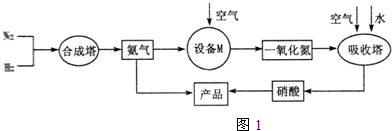
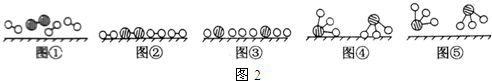
 、
、 、
、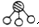 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
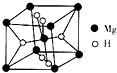 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
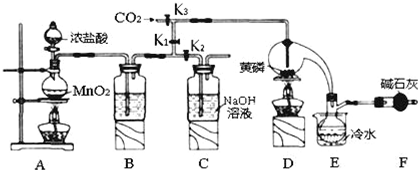
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com