
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
分析 A、燃烧热是指完全燃烧1mol物质生成最稳定的产物的过程所放出的热量;
B、反应物的总能量小于生成物的总能量为吸热反应;
C、根据化学方程式②可知,甲醇转化为氢气的过程就是放热的;
D、气体甲醇变为液态甲醇的过程是放热的过程.
解答 解:A、燃烧热是指完全燃烧1mol物质生成最稳定的产物的过程放出的热量,甲醇燃烧对应产物应该是二氧化碳气体和液态的水,不是氢气,故A错误;
B、反应①时吸热反应,反应物的总能量小于生成物的总能量,故B错误;
C、根据化学方程式②可知,甲醇转化为氢气的过程就是放热的,故C错误;
D、气体甲醇变为液态甲醇的过程是放热的过程,根据反应②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ•mol-1 知道,液态甲醇发生此反应放出的热量会小于192.9kJ,故D正确;
故选D.
点评 本题考查学生物质具有的能量和化学反应的吸放热之间的关系,注意知识的归纳和整理是解题的关键,难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
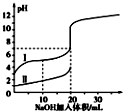 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A气体是NH3,B气体是CO2 | |
| B. | 侯氏制碱法的工艺过程应用了物质溶解度的差异 | |
| C. | 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用电解熔融CeO2制取金属铈,铈在阳极生成 | |
| B. | 58138Ce、58142Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+═Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子的物质的量浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间的关系是c(H+)=c(CH3COO-)-c(Na+)+c(OH-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com