
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子的物质的量浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间的关系是c(H+)=c(CH3COO-)-c(Na+)+c(OH-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
分析 A.pH=7溶液中c(H+)=c(OH-),则c(Cl-)=c(NH4+);
B.根据溶液中的电荷守恒判断;
C.pH相同时盐酸与醋酸的浓度不同;
D.Na2S的水解程度比NaHS大.
解答 解:A.常温下,pH=7的NH4Cl与氨水的混合溶液存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),pH=7溶液中c(H+)=c(OH-),则c(Cl-)=c(NH4+),所以离子浓度大小顺序为:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故A错误;
B.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,根据电荷守恒可知:c(H+)=c(CH3COO-)-c(Na+)+c(OH-),故B正确;
C.pH相同时盐酸与醋酸的浓度不同,由于醋酸部分电离,醋酸的浓度大于氢离子浓度,盐酸的浓度等于氢离子浓度,所以醋酸的浓度大于盐酸的浓度,则等体积时消耗的氢氧化钠醋酸多,故C错误;
D.Na2S的水解程度比NaHS大,水解程度越大,则碱性越强,所以Na2S溶液的pH大,故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,侧重于基础知识的综合应用的考查,明确电荷守恒、物料守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m=n | C. | m<n | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
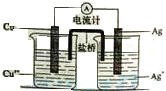 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用X表示此反应的反应速率是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA | |
| B. | 1 L 0.1mol•L-1的NH4Cl溶液中含有Cl-数目为0.1NA | |
| C. | 1mol Na2O2固体与足量CO2反应转移电子数为1NA | |
| D. | 标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3.H20═Al02-+4NH4++2H20 | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaC03+CO32-+2 H2O | |
| C. | 食醋腐蚀大理石面板:CaCO3+2 H+═Ca2++CO2+H2O | |
| D. | 少量钠投入硫酸铜溶液中:2Na+Cu2+═2 Na++Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com