
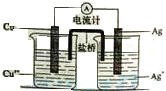
 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.分析 (1)银在空气中,能与空气中氧及含硫化合物反应生成黑色的Ag2S;
(2)n(AgNO3)=0.05L×0.018mol/L=0.0009mol,n(HCl)=0.05L×0.020mol/L=0.001mol,硝酸银和HCl发生反应AgNO3+HCl=AgCl↓+HNO3,根据方程式知,HCl剩余,混合溶液中c(Cl-)=$\frac{(0.001-0.0009)mol}{0.05L+0.05L}$=10-3 mol/L,溶液中c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$;实际上氢离子不参加反应,则溶液中c(H+)=$\frac{0.001mol}{0.05L+0.05L}$=0.01mol/L,溶液的pH=-lgc(H+);
(3)红棕色气体是NO2,该反应中Ag元素化合价由+1价变为0价、N元素化合价由+5价变为+4价,根据氧化还原反应知,还有元素失电子化合价升高,只能是O元素失电子生成O2,根据反应物、生成物及反应条件书写方程式;
(4)该原电池中,Cu的活动性大于Ag,Cu易失电子发生氧化反应,所以Cu是负极、Ag是正极,正极上银离子得电子发生还原反应.
解答 解:(1)长期放置在空气中的银制品,能与空气中氧及含硫化合物反应生成黑色的Ag2S,所以其表面会逐渐变黑,失去银白色的光泽,
故答案为:C;
(2)n(AgNO3)=0.05L×0.018mol/L=0.0009mol,n(HCl)=0.05L×0.020mol/L=0.001mol,硝酸银和HCl发生反应AgNO3+HCl=AgCl↓+HNO3,根据方程式知,HCl剩余,混合溶液中c(Cl-)=$\frac{(0.001-0.0009)mol}{0.05L+0.05L}$=10-3 mol/L,溶液中c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1{0}^{-3}}$mol/L=1.8×10-7mol/L;实际上氢离子不参加反应,则溶液中c(H+)=$\frac{0.001mol}{0.05L+0.05L}$=0.01mol/L,溶液的pH=-lgc(H+)=-lg0.01=2,
故答案为:1.8×10-7;2;
(3)红棕色气体是NO2,该反应中Ag元素化合价由+1价变为0价、N元素化合价由+5价变为+4价,根据氧化还原反应知,还有元素失电子化合价升高,只能是O元素失电子生成O2,根据反应物、生成物及反应条件书写方程式为2AgNO3$\frac{\underline{\;光照\;}}{\;}$2Ag+2NO2↑+O2↑,
故答案为:2AgNO3$\frac{\underline{\;光照\;}}{\;}$2Ag+2NO2↑+O2↑;
(4)该原电池中,Cu的活动性大于Ag,Cu易失电子发生氧化反应,所以Cu是负极、Ag是正极,正极上银离子得电子发生还原反应,电极反应式为Ag++e-=Ag,
故答案为:Ag++e-=Ag.
点评 本题考查原电池原理、氧化还原反应、pH计算、溶度积常数等知识点,综合性较强,题目难度中等,明确正负极判断及其发生的反应、溶度积常数含义、氧化还原反应本质等知识点即可解答,注意(2)题要进行过量计算,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用电解熔融CeO2制取金属铈,铈在阳极生成 | |
| B. | 58138Ce、58142Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+═Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨的反应中,高温、高压有利于氨的合成 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 保存FeSO4溶液时需要往里加入光亮的铁钉 | |
| D. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子的物质的量浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间的关系是c(H+)=c(CH3COO-)-c(Na+)+c(OH-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态植物油通过催化加氢可制得人造奶油 | |
| B. | 饱和(NH4)2SO4溶液可使蛋白质变性 | |
| C. | 淀粉和蛋白质的组成元素相同 | |
| D. | 石蜡油经分馏可以获得乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA 个水分子所占的体积约为 22.4L | |
| B. | 20℃、1.01×105Pa 时,0.5mol O2的质量是 16 g | |
| C. | 同温同压下,1mol He 与 6.02×1023个 N2 所占体积相等 | |
| D. | 1mol CH4的质量与NA个CH4分子的质量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com